Нпвп гастропатия что это
Профилактика НПВС-гастропатий у больных с факторами риска желудочно-кишечных повреждений
Нестероидные противовоспалительные средства (НПВС) представляют собой одну из наиболее востребованных групп препаратов. По данным Американской ассоциации ревматологов, более 5% населения планеты используют НПВС. Однако частота повреждений верхних отделов
Нестероидные противовоспалительные средства (НПВС) представляют собой одну из наиболее востребованных групп препаратов. По данным Американской ассоциации ревматологов, более 5% населения планеты используют НПВС. Однако частота повреждений верхних отделов желудочно-кишечного тракта (ЖКТ) — эрозивно-язвенные поражения, перфорации, кровотечения — при регулярном применении этих препаратов может достигать 40% [1]. Серьезную проблему представляет применение НПВС у больных с факторами риска повреждения верхних отделов ЖКТ. Обострение язвенной болезни, эрозивный гастродуоденит или рефлюкс-эзофагит, а также указания на них в анамнезе являются противопоказаниями к применению НПВС. Однако выраженность болевого синдрома нередко заставляет проводить противовоспалительную терапию и у таких больных.
К факторам риска относят наличие эрозивно-язвенных поражений желудка и двенадцатиперстной кишки и кровотечений из верхних отделов ЖКТ в анамнезе, возраст старше 65 лет, тяжелый ревматоидный артрит, использование больших доз или одновременный прием разных НПВС, комбинацию НПВС с глюкокортикоидами, сопутствующую антикоагулянтную терапию, женский пол, наличие Нelicobacter pylori, курение [2, 3].
При наличии факторов риска предлагаются различные подходы для определения тактики ведения больных.
При наличии двух и более факторов риска частота осложнений терапии НПВС возрастает, что оправдывает выбор двух профилактических тактик одновременно, например применение селективных ингибиторов ЦОГ-2 и ИПП. Количество больных с патологией верхнего отдела ЖКТ, нуждающихся в терапии НПВС, достаточно велико, что и явилось причиной для проведения настоящего исследования.
Целью работы явилась оценка эффективности, переносимости и безопасности применения препарата найз (нимесулид) в дозировке 100 мг 2 раза в день в течение 4 нед для лечения заболеваний суставов и позвоночника (остеоартрита, остеоартроза и остеохондроза) у больных с сопутствующими эрозивно-язвенными поражениями верхних отделов ЖКТ в стадии ремиссии/умеренного обострения на фоне профилактической терапии препаратом омез (омепразол) в дозировке 20 мг 2 раза в сутки.
Задачи исследования сводились к следующему:
Критериями включения в исследование служили:
В исследование не включались пациенты:
Найз (таблетки по 100 мг) назначался в дозе 100 мг 2 раза в день. Продолжительность лечения составляла 28–35 дней — в зависимости от выраженности обострения патологии суставов. В период исследования не допускался прием других НПВС, анальгетиков и глюкокортикостероидов. Одновременно с найзом назначался омез в дозе 20 мг 2 раза в день на весь период приема препарата.
Перед назначением комбинированной терапии диагноз неврологической, ревматологической патологии был верифицирован невропатологом, ревматологом с применением достаточных диагностических процедур. С учетом гастроэнтерологического анамнеза, проводили эзофагогастродуоденоскопию (ЭГДС) до и после курса лечения. До и после окончания терапии проводилось изучение общего и биохимического (билирубин, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), гамма-глютаматтранспептидаза (гамма-ГТ), щелочная фосфатаза) анализов крови.
Субъективная оценка эффективности лечения состояла в выборе пациентом одного из следующих показателей: значительное улучшение; улучшение; отсутствие эффекта; ухудшение.
Субъективная оценка переносимости — выбор одного из следующих показателей: хорошая, удовлетворительная, плохая.
Объективная оценка проводилась врачом на основании динамики клинических, лабораторных и инструментальных показателей. Позитивная динамика двух-трех показателей считалась значительным улучшением, одного-двух — улучшением. Неэффективным лечение признавалось при отсутствии динамики показателей. Преобладание отрицательной динамики расценивалось как ухудшение.
Оценка безопасности применения основывалась на сопоставлении результатов: общего и биохимического анализов крови до и после лечения; ЭГДС до и после лечения. Появление эрозивно-язвенных повреждений слизистой или ухудшение исходного состояния слизистой расценивались как побочный эффект, связанный с приемом найза.
Всего в исследовании приняли участие 30 больных (14 мужчин, 16 женщин) в возрасте от 22 до 70 лет (средний возраст составил 53,7 ± 3,0 года). Болевой синдром был вызван остеохондрозом различных отделов позвоночника у 18 из них, остеоартрозом различных суставов — у 10, ревматоидным полиартритом — у 2 пациентов.
Для оценки симптоматики заболеваний суставов и позвоночника использовался ряд показателей, частота и характеристики которых представлены в таблице 1.
Что касается функциональной недостаточности, у 4 пациентов отмечена нулевая степень, у 13 — I степень, у 11 — II степень, у 2 — III степень.
Все пациенты имели отягощенный гастроэнтерологический анамнез.
В связи с необходимостью назначения противовоспалительной терапии всем больным до лечения проводилась ЭГДС.
Cреди пациентов с язвенной болезнью двенадцатиперстной кишки в анамнезе (9 больных) к моменту начала противовоспалительной терапии более 2/3 имели эрозивно-язвенные поражения. У 4 больных с обострением язвенной болезни двенадцатиперстной кишки и 1 больного с обострением язвенной болезни желудка лечение найзом было начато на фоне рубцующихся язвенных дефектов. При эрозивных гастритах и бульбитах, в связи с болями в позвоночнике или суставах, терапию найзом проводили, не дожидаясь заживления эрозий. Кроме того, у 5 больных при эндоскопическом исследовании был обнаружен рефлюкс-эзофагит (у 4 — катаральный, у 1 — эрозивный I степени).
Результаты исследования
Динамика клинических проявлений. Основной причиной назначения противовоспалительной терапии являлся болевой синдром, связанный с патологией позвоночника и суставов. Динамика основной симптоматики под влиянием терапии найзом представлена в таблице 2.
Функциональная недостаточность на фоне проводимой терапии характеризовалась следующим образом: 0 степень отмечалась до лечения у 4 пациентов, после лечения — у 19; I степень — у 13 до лечения и у 9 — после терапии; II степень — у 11 до и у 2 — после, III степень — у 2 до и ни у одного — после лечения.
Таким образом, курсовое лечение найзом приводило к достоверному уменьшению интенсивности болей при движении и пальпации, сокращению длительности утренней скованности и степени функциональной недостаточности.
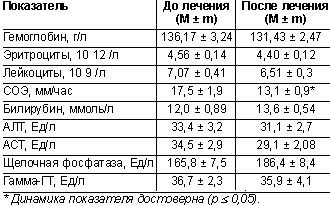
Динамика лабораторных данных. В рамках оценки безопасности применения лекарственного средства проводилось исследование общего и биохимического анализов крови до и после лечения. Результаты представлены в таблице 3.
 |
| Таблица 3. Результаты изучения лабораторных данных до и после лечения |
Приведенные данные демонстрируют отсутствие динамики лабораторных показателей, что свидетельствует о безопасности применения найза в использованных дозах в течение 28 дней. Достоверное снижение СОЭ отражает уменьшение воспалительной реакции после терапии.
Динамика эндоскопической картины. Из 4 пациентов с язвенной болезнью двенадцатиперстной кишки, принятых в исследование с остаточными язвами, заживление наблюдалось у 3 человек. В одном случае появилась острая язва луковицы двенадцатиперстной кишки и эрозивный эзофагит III степени. У 3 пациентов с язвенной болезнью двенадцатиперстной кишки в анамнезе, исходно имевших эрозивный бульбит и эрозивный гастрит, отмечалось заживление эрозий на фоне лечения. У 1 из 2 больных, к началу исследования имевшего рубцово-язвенную деформацию луковицы двенадцатиперстной кишки и поверхностный гастрит, появился эрозивный эзофагит II степени, состояние слизистой оболочки желудка и двенадцатиперстной кишки не изменилось. Обращает на себя внимание тот факт, что появление эрозивного эзофагита манифестировало появлением изжоги и отмечалось у больных в возрасте 70 лет.
У пациентов с язвенной болезнью желудка в анамнезе наблюдали заживление остаточного язвенного дефекта (1 больной) и эрозивного гастрита (1 больной).
В группе больных с эрозивным антральным гастритом в анамнезе, заживление эрозий наблюдали у 8 из 10 человек, однако у одного из них на фоне заживления эрозий возник эрозивный эзофагит I степени. У оставшихся 2 пациентов ухудшения состояния слизистой оболочки желудка отмечено не было. Ни у одного из 7 больных с эрозивным антральным гастритом в анамнезе, имевших на момент включения в исследование очаговый антральный гастрит, ухудшения состоянии слизистой оболочки не отмечено.
У 2 больных с резекцией 2/3 желудка (по поводу язвенной болезни двенадцатиперстной кишки) повреждений слизистой оболочки верхних отделов ЖКТ после терапии найзом обнаружено не было, более того, у пациентки с исходным эрозивным эзофагитом I степени при контрольном исследовании отмечена эпителизация эрозии пищевода.
Таким образом, отрицательная эндоскопическая динамика при использовании комбинированной терапии наблюдалась у 3 больных (10%) в виде эрозивного эзофагита I–III степени, и в одном случае сочеталась с появлением острых язв луковицы двенадцатиперстной кишки. При этом все эти пациенты отметили появление изжоги.
Оценка эффективности, безопасности и переносимости терапии. Субъективная оценка эффективности состояла в выборе пациентом одного из следующих показателей: значительное улучшение, улучшение, отсутствие эффекта, ухудшение. Субъективная оценка переносимости предполагала выбор больным одного из следующих показателей: хорошая, удовлетворительная, плохая. Значительное улучшение отметили 8 больных, улучшение — 22; хорошая переносимость наблюдалась у 26 пациентов, удовлетворительная — у 4.
Эффективность комбинированной терапии получила высокую оценку: улучшение отметили 73,3% больных, значительное улучшение — 26,7%. Переносимость была охарактеризована пациентами как хорошая в 86,6% и как удовлетворительная в 13,3% случаев. Удовлетворительную оценку лечению дали 3 человека в связи с появлением рефлюкс-эзофагита, которые отметили появление изжоги и тошноты, у одного пациента отмечались сухость во рту и тошнота. Следует отметить, что наблюдаемые побочные эффекты были выражены слабо, возникали на 2–4-й день лечения и не привели к отмене препарата.
Объективная оценка результатов лечения проводилась врачом на основании динамики клинических, лабораторных и инструментальных показателей. Позитивная динамика двух-трех показателей считалась значительным улучшением, одного-двух — улучшением. Неэффективным лечение признавалось при отсутствии динамики показателей. Преобладание отрицательной динамики расценивалось как ухудшение. Значительное улучшение отмечено у 8 больных, улучшение — у 22.
Врачебная оценка эффективности противовоспалительного действия найза совпадала с оценкой эффективности по данным пациентов.
Оценка безопасности применения основывалась на сопоставлении результатов общего и биохимического анализов крови до и после лечения; ЭГДС до и после лечения. Появление эрозивно-язвенных повреждений или ухудшение исходного состояния слизистой оболочки желудка и двенадцатиперстной кишки расценивалось как побочный эффект, связанный с приемом найза.
Динамика общего и биохимического анализов крови у всех пациентов отсутствовала. Исключение составило уменьшение СОЭ после лечения, что свидетельствовало о снижении воспаления.
Появление эрозивных повреждений слизистой оболочки пищевода наблюдали у 3 больных, в одном случае — в сочетании с появлением острой язвы двенадцатиперстной кишки. Таким образом, применение комбинированной терапии для лечения заболеваний суставов и позвоночника (остеоартрита, остеоартроза и остеохондроза) у больных с сопутствующими эрозивно-язвенными поражениями верхних отделов ЖКТ было безопасным в 90% случаев.
Основным повреждающим фактором НПВС является снижение локального синтеза простагландинов. Последние клинические и экспериментальные данные указывают на то, что традиционные НПВС замедляют заживление пептических язв, влияя на действие ростовых факторов, снижая пролиферацию эпителиальных клеток и ангиогенез в крае язвы, замедляя созревание грануляционной ткани [10]. Применение селективных ингибиторов ЦОГ-2 также приводит к замедлению заживления желудочных язв, сравнимому с таковым при использовании традиционных НПВС [10]. Появляются сообщения о гастроинтестинальных кровотечениях, об эзофагитах, возникших при использовании селективных ингибиторов ЦОГ-2 [5, 6].
По результатам наших собственных исследований были выявлены три случая появления эрозивного эзофагита I–III степени, и в одном случае он развивался в сочетании с острыми язвами двенадцатиперстной кишки. Причины неэффективности препарата омез у этих больных могут быть следующими: больные резистентны к действию омеза, т. е. являются non-responders; подавление кислотной продукции было адекватным, но сопровождалось нарушениями моторики верхних отделов ЖКТ, как при гастроэзофагеальной рефлюксной болезни, видимо, с рефлюксом желчи в пищевод и развитием эрозивного эзофагита. Вторая причина представляется более вероятной у 2 больных в возрасте 70 лет, первая причина — у пациента 53 лет.
При появлении жалоб на изжогу, тошноту необходимо провести эндоскопическое исследование верхних отделов ЖКТ и суточной рН-метрии на фоне терапии омезом. Сохранение кислотной продукции в этой ситуации должно привести к пересмотру кислотосупрессивной терапии. При адекватном подавлении желудочной секреции будет оправданным добавление к терапии прокинетиков, сукральфата или магалфила в обычных дозах.
В заключение хотелось бы отметить, что лечение найзом в сочетании с омезом у больных с поражением опорно-двигательного аппарата и сопутствующей патологией желудка и двенадцатиперстной кишки в стадии обострения приводило к улучшению основной (в 100% случаев) и сопутствующей (в 90% случаев) патологии ЖКТ. 10% больных имели осложнения (эрозивный эзофагит, острая язва луковицы двенадцатиперстной кишки).
При появлении или усугублении изжоги, боли в эпигастральной области, тошноты больным, принимающим НПВС, показана ЭГДС для решения вопроса о дальнейшей тактике ведения пациента, возможности дальнейшей терапии НПВС. Следует также учитывать, что соответствия между клиническими проявлениями НПВС-гастропатии и эндоскопическими «находками» не существует, поэтому эндоскопический контроль, особенно в ранние сроки лечения (первые 1–2 мес), является обязательным и адекватным методом профилактики тяжелых осложнений.
Использование комбинированной терапии найз + омез для лечения заболеваний суставов и позвоночника (остеоартрита, остеоартроза и остеохондроза) возможно у больных с сопутствующими эрозивно-язвенными поражениями верхних отделов ЖКТ и множественными факторами риска развития гастроинтестинальных побочных эффектов НПВС. При этом НПВС-гастропатия развивается в 3 раза реже, чем при использовании неселективных НПВС.
По вопросам литературы обращайтесь в редакцию.
О. Н. Минушкин, доктор медицинских наук, профессор
Л. В. Масловский, кандидат медицинских наук, доцент
В. М. Леонов
МЦ УД Президента РФ, Москва
НПВП-индуцированная гастропатия: от понимания механизмов развития к разработке стратегии профилактики и лечения
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Нестероидные противовоспалительные препараты (НПВП) относятся к числу наиболее распространенных лекарственных средств в клинической практике. Вместе с тем, наряду с высокой фармакотерапевтической эффективностью по основным показаниям, с приемом НПВП ассоциируется целый спектр осложнений. Особую актуальность приобретает негативное специфическое действие НПВП на слизистую оболочку ЖКТ, проявляющееся легкой диспепсией либо развитием эрозий, пептических язв, кровотечения. Опубликованные практические рекомендации направлены на снижение риска развития желудочно-кишечных расстройств при применении НПВП и позволяют клиницистам принять обоснованное решение относительно выбора препарата, необходимости профилактики и принципов лечения НПВП-гастропатий в конкретном клиническом случае. Наряду с назначением селективных НПВП с наименьшим числом нежелательных явлений с целью профилактики и лечения гастропатий показано применение ингибиторов протонной помпы (ИПП). Пантопразол (оригинальный препарат Контролок) обладает не только клинической эффективностью, но и минимальными лекарственными взаимодействиями. Данный факт позволяет считать пантопразол наиболее безопасным ИПП, отдавать ему предпочтение в случаях, когда необходимо назначать несколько препаратов со сходным путем метаболизма в печени, при этом быть уверенным в отсутствии риска развития симптомов передозировки или уменьшении эффекта этих препаратов.
Ключевые слова: нестероидные противовоспалительные препараты (НПВП), НПВП-гастропатии, ингибиторы протонной помпы, пантопразол, Контролок.
Для цитирования: Балукова Е.В. НПВП-индуцированная гастропатия: от понимания механизмов развития к разработке стратегии профилактики и лечения. РМЖ. 2017;10:697-702.
NSAID-induced gastropathy: fr om the mechanisms comprehension to the development of prevention and treatment strategy
Balukova E.V.
The first St. Petersburg State Medical University named after I.P. Pavlov
Non-steroidal anti-inflammatory drugs (NSAIDs) are the most common drugs in clinical practice. At the same time, along with the high pharmacotherapeutic efficacy according to the main indications, a wide range of complications is associated with the intake of NSAIDs. It is especially important that NSAIDs have a negative specific effect on the mucosa of the gastrointestinal tract, manifested by mild dyspepsia or the development of erosions, peptic ulcers, bleeding. The published practical recommendations are aimed at reducing the risk of developing gastrointestinal disorders when using NSAIDs and allow clinicians to make an informed decision regarding the choice of the drug, the need for prevention and the principles of treatment of NSAIDs in a particular clinical case. Along with the appointment of selective NSAIDs with the least number of adverse events for the prevention and treatment of gastropathies, the use of proton pump inhibitors (PPI) is indicated. Pantoprazole (the original drug Controlock) has not only clinical efficacy, but also minimal drug interactions. This fact allows us to consider pantoprazole as the safest PPI, and gives it an advantage in cases wh ere it is necessary to prescribe several drugs with a similar way of metabolism in the liver, while being sure that there is no risk of developing symptoms of an overdose or reducing the effect of these drugs.
Key words: nonsteroidal anti-inflammatory drugs (NSAIDs), NSAIDs-gastropathies, proton pump inhibitors, pantoprazole, Controlock
For citation: Balukova E.V. NSAID-induced gastropathy: from the mechanisms comprehension to the development of prevention and treatment strategy // RMJ. 2017. № 10. P. 697–702.
В статье рассмотрена проблема НПВП-индуцированной гастропатии
Клинические варианты НПВП-гастропатии
Факторы риска развития повреждений слизистой оболочки ЖКТ
Лечение и профилактика НПВП-гастропатий
Только для зарегистрированных пользователей
Абдулганиева Д.И. Особенности ведения больных с НПВП-индуцированной гастропатией // Клинические перспективы гастроэнтерологии, гепатологии. 2011. № 6. С. 23–29.
Особенности ведения больных с НПВП-индуцированной гастропатией
Государственное бюджетное образовательное учреждение высшего профессионального образования «Казанский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Абдулганиева Диана Ильдаровна – кандидат медицинских наук, доцент кафедры госпитальной терапии Казанского государственного медицинского университета. Контактная информация для переписки: e-mail: Diana_s@mail.ru; 420012, Казань, Бутлерова, 49, КГМУ, кафедра госпитальной терапии
Цель публикации. Продемонстрировать индивидуальные особенности ведения больных в зависимости от сочетания патогенетических механизмов развития НПВП-индуцированной гастропатии.
Основные положения. В статье приводятся современные сведения о гетерогенности патогенеза НПВП-индуцированной гастропатии и собственные клинические наблюдения вариантов течения данной патологии у пациентов с ревматоидным артритом.
Заключение. Определенной группе больных с НПВП-индуцированной гастропатией с клиническим «перекрестом» болевого и диспептического синдромов при НПВП-гастропатии симптоматически и патогенетически обосновано назначение не только антисекреторных, но и прокинетических препаратов.
Ключевые слова: НПВП-гастропатия, клинический пример, патогенетическое лечение.
Management of NSAID-induced gastropathy
The aim of publication. To demonstrate specific features of management of patients according to combination of pathogenic mechanisms of NSAID-induced gastropathy.
Original positions. The article presents modern data on heterogeneity of NSAID-induced gastropa-thy pathogenesis and original cases of clinical course variants at patients with rheumatoid arthritis.
Conclusion. Certain group of patients with NSAID-induced gastropathy with clinical «cross-over» of pain and dyspeptic syndrome requires prokinetic drugs along with antisecretory for both symptom relief and pathogenic treatment.
Key words: NSAID-induced gastropathy, clinical case, pathogenic treatment.
Нестероидные противовоспалительные препараты (НПВП) – наиболее часто используемые лекарственные средства в лечебной практике [11]. Более 30 млн человек в мире употребляют НПВП ежедневно как обезболивающие, противовоспалительные и антиагрегантные средства [18].
Основной круг потребителей НПВП составляют больные с хронической патологией суставов, при которых боль и воспаление являются основными клиническими проявлениями [9]. К сожалению, клинические достоинства НПВП ограничиваются риском развития серьезных осложнений. Наиболее распространенной и опасной, нежелательной реакцией, возникающей при приеме НПВП, является НПВП-индуцированная гастропатия [3].
Медико-социальная значимость проблемы такова, что ревматологи (а именно в ревматологической практике эти препараты назначаются наиболее часто) называют НПВП-гастропатию «второй ревматической болезнью» [10]. Предложенным в 1986 г. S.H. Roth термином NSAID-gastropathy (НПВП-гастропатия) в мире принято обозначать эрозивно-язвенные поражения гастродуоденальной зоны, связанные с приемом этих препаратов и имеющие характерную клинико-эндоскопическую картину [11, 23]. Необходимо отметить, что в последние несколько лет в литературе активно обсуждается НПВП-индуцированное поражение не только гастродуоденальной области, но и пищевода при приеме препаратов этой группы [4].
Патогенез НПВП-гастропатии включает в себя несколько механизмов [30]. Ключевую роль играет ингибирование фермента циклооксигеназы (ЦОГ), имеющего два изомера ЦОГ-1 и ЦОГ-2. Угнетение активности ЦОГ-1 (структурной) приводит к снижению синтеза простагландинов PgE2 и PgI2, которые выполняют «цитопротективную» функцию в слизистой оболочке желудка [11]. Спектр основных физиологических эффектов простагландинов включает: стимуляцию секреции защитных гидрокарбонатов и слизи; усиление местного кровотока слизистой оболочки; активацию пролиферации клеток в процессах нормальной регенерации [7]. Угнетение активности ЦОГ-2 (индуцированной) собственно и определяет противовоспалительное действие. Таким образом, снижение синтеза простагландинов, а следовательно, защитных резервов слизистой оболочки желудка и двенадцатиперстной кишки (ДПК) является основной причиной НПВП-гастропатии.
Однако простагландиновый механизм не является единственным объяснением неблагоприятного влияния НПВП на слизистую оболочку [27]. Известно, что эффектами, оказываемыми НПВП, являются: снижение кровотока слизистой оболочки, зависящее не только от простагландинового, но и от секреторного фактора, непосредственное изменение секреции соляной кислоты, образование «белых тромбов» [20, 27, 29] как последствие воспалительной адгезии нейтрофилов на сосудистый эндотелий [16, 17], изменение молекул эндотелиальной и лейкоцитарной адгезии [30], а также функции эндотелия сосудов в месте воспаления [28]. Определенный интерес с практической точки зрения представляет и изменение на фоне приема НПВП моторики верхних отделов желудочно-кишечного тракта (ЖКТ) [25], которое приводит к усугублению язвенно-геморрагических повреждений слизистой [22, 26, 27]. До настоящего времени не совсем ясно значение Helicobacter pylori в патогенезе НПВП-гастропатии [6].
Кроме того, известен и топический эффект НПВП на слизистую оболочку, который не связан с простагландиновым механизмом. Прямое «контактное» повреждающее действие НПВП обусловлено их способностью непосредственно проникать в клетки эпителия в кислой среде, где они вызывают обратную диффузию Н+, нарушают качество слизи и снижают концентрацию бикарбонатов [8, 29]. Вследствие этого слизистая оболочка желудка становится более доступной для местного токсического повреждения соляной кислотой, желчными кислотами и кислотными печеночными метаболитами НПВП, панкреатическими ферментами на фоне дуоденогастрального рефлюкса [11, 19, 21].
Таким образом, патогенетические механизмы, вызывающие развитие НПВП-гастропатии, являются крайне гетерогенными.
Эрозивно-язвенные поражения желудка и ДПК (сопровождающиеся диспепсией или бессимптомные) обнаруживаются при эндоскопическом исследовании практически у 40% больных, длительно принимающих НПВП [6].
Симптоматика рассматриваемой патологии хорошо известна клиницистам. Это боли (чаще в эпигастральной области), связанные с приемом препарата (пациенты переходят на его прием после еды, чтобы снизить неприятные ощущения), диспептический синдром – ощущение тяжести после еды, чувство быстрого насыщения, вздутие в области эпигастрия, реже – тошнота, рвота. Для болевого и диспептического синдромов не характерна сезонность в отличие от «классической» язвенной болезни. Клинически НПВП-ассоциированные повреждения пищевода проявляются симптоматикой гастроэзофагеальной рефлюксной болезни (ГЭРБ) – прежде всего изжогой [4, 12].
Следует особо подчеркнуть дисбаланс между клиническими проявлениями НПВП-гастропатии и выраженностью эндоскопической картины. Примерно у 30–40% обследуемых, получающих длительную (более 6 нед) терапию НПВП, отмечаются симптомы диспепсии, которые не коррелируют с данными, полученными при эзофагогастродуоденоскопии (ЭГДС). Так, до 40% больных с эрозивно-язвенными изменениями слизистой верхних отделов ЖКТ не предъявляют жалоб, и, наоборот, до 50% пациентов с диспепсией имеют нормальную слизистую оболочку [6].
С позиций практикующего врача необходимо помнить, что у лиц, предъявляющих жалобы на неприятные ощущения со стороны ЖКТ и имеющих эндоскопические признаки, характерные для НПВП-гастропатии, серьезные осложнения выявляются чаще, чем у тех, кто не испытывает неприятных ощущений [6]. Эта группа больных с клиническими и эндоскопическими проявлениями НПВП-гастропатии должна находиться под особым наблюдением лечащего врача.
Случай из клинической практики
Больная Т., 42 лет, поступила в ревматологическое отделение с диагнозом «ревматоидный артрит: полиартрит, медленно прогрессирующее течение, серопозитивный (по анти-MCV), активность 2 (DAS 28 – 6,3), рентгенологическая стадия 2, функциональная недостаточность суставов 2-й степени». При поступлении жалобы на ноющие боли, усиливающиеся при движении, периодическую припухлость мелких суставов кистей, правого локтевого и лучезапястных суставов, утреннюю скованность продолжительностью до 2 ч, эпизоды субфебрильной температуры. Пациентку беспокоили также выраженный дискомфорт в эпигастральной области, чувство тяжести и ощущение переполнения после приема пищи, иногда сопровождающиеся болью, горечь во рту, усиливающуюся после еды, отрыжка воздухом вне зависимости от приема пищи, изжога 3–4 раза в неделю.
Из анамнеза заболевания: страдает ревматоидным артритом (РА) с 2007 г., в настоящее время принимает метипред 8 мг/сут, сульфасалазин 2 г/сут, периодически при усилении суставного синдрома – диклофенак натрия в дозе 50–150 мг/сут (старается принимать его после еды, запивать молоком), при дискомфорте в животе принимала антациды. Не курит, алкоголем не злоупотребляет, наследственность не отягощена, язвенной и гастроэзофагеальной болезни в анамнезе нет. В течение примерно последнего месяца жалобы на ухудшение состояния в виде усиления суставного синдрома, утренней скованности. Самостоятельно возобновила прием диклофенака натрия в дозе 100 мг, в последующем 150 мг в сутки. Скованность и боли в суставах стали значительно меньше, однако при повышении дозы НПВП до 150 мг/сут отмечает появление диспептического синдрома, выраженной изжоги и периодических болей «под ложечкой».
Объективно: состояние удовлетворительное, телосложение нормостеническое, кожные покровы чистые, язык у корня обложен белым налетом. Правый и левый лучезапястный суставы, правый локтевой сустав – без признаков деформации, болезненность при пальпации, ограничение в объеме пассивных и активных движений, мелкие суставы кистей и стоп – без видимых признаков воспаления, болезненность при пальпации. Тоны сердца ясные, ритмичные, слегка приглушены, АД 115/70 мм рт. ст., пульс 72 удара в минуту. Дыхание везикулярное, проводится по всем полям, хрипы не выслушиваются. Живот при пальпации мягкий, чувствительный в эпигастральной области, симптом Менделя слабо положительный; перкуторные размеры hepar et lien не увеличены. Симптом Пастернацкого отрицательный с обеих сторон.
Лабораторно-инструментальные методы исследования: в общем анализе крови отмечено повышение СОЭ до 28 мм/ч, Hb – 113 г/л. Ревматоидный фактор положительный.
Результаты ЭГДС: пищевод свободно проходим, слизистая гиперемирована в нижних отделах, слизистая желудка диффузно резко гиперемирована (по типу «пылающей слизистой»), в антральном отделе имеются множественные подслизистые кровоизлияния, в полости – мутная, пенистая желчь объемом до 200 мл, привратник проходим, луковица ДПК умеренно раздражена. Цитология на Helicobacter pylori положительная.
Пациентке было проведено суточное рН-мониторирование (рис. 1), которое является прямым методом оценки состояния желудочной секреции и косвенным методом оценки моторики: колебания уровня рН до 7,0 и выше в теле желудка свидетельствуют о наличии и выраженности дуоденогастрального рефлюкса, ниже 4,0 в пищеводе – о гастроэзофагеальном рефлюксе (ГЭР) [2, 13].
Рис. 1. Суточная рН-метрия больной Т., 42 лет, страдающей ревматоидным артритом
Как видно из представленных на рисунке данных, у больной отмечался выраженный ГЭР (стрелками на графике пищевода обозначены эпизоды продолжительных рефлюксов с рН

