Норадреналин в реанимации для чего
Раннее введение норадреналина повышает выживаемость и улучшает прогноз пациентов, перенесших внезапную остановку сердца
От внезапной остановки сердца (ВОС) в России ежегодно умирает порядка 250 000 человек (8-16 случаев на 10 000 населения) – 0.1-2% взрослого населения страны. Если остановка сердца происходит во внебольничных условиях, выживаемость пациентов, как правило, не превышает 10%, а у трети выживших развиваются стойкие неврологические нарушения.
Около 25-50% случаев внебольничной ВОК развиваются в результате фибрилляции желудочков или желудочковой тахикардии. В этих случаях выживаемость и прогноз пациентов определяются как можно более ранним проведением электрической дефибрилляции. Дополнительно после трех безуспешных попыток дефибрилляции в процессе сердечно-легочной реанимации рекомендуется вводить норадреналин. Однако в обновленных рекомендациях по проведению сердечно-легочной реанимации и экстренной сердечно-сосудистой помощи Американской кардиологической ассоциации 2020 года предлагается более раннее временно окно для введения норадреналина – после первого разряда дефибриллятора. Как показали результаты ретроспективного исследования, представленного 13 ноября на Ежегодной научной сессии Американской кардиологической ассоциации, это позволяет повысить вероятность восстановления спонтанного кровообращения (ВСК; return of spontaneous circulation), выживаемость и неврологический прогноз пациентов, перенесших ВОС.
Авторы работы проанализировали данные 6416 пациентов в возрасте от 54 до 74 лет (медиана возраста – 64 года; 5136 [80%] мужчин), 35% (n=2226) из которых получали норадреналин в течение четырех минут после первого разряда дефибриллятора. ВСК было достигнуто у 80% (n=5119) больных, 16% (n=996) были выписаны из больницы с благоприятным неврологическим прогнозом (сумма баллов по модифицированной шкале Рэнкина ≤ 3), однако только 1 из 5 (19%; n=1237) пациентов доживал до выписки из больницы.
Введение норадреналина спустя 4 минуты после первого разряда дефибриллятора значительно снижало вероятность ВСК (отношение шансов, ОШ 0.58, 95% ДИ [0.51-0.68]; p
ИНСТРУКЦИЯ
по медицинскому применению лекарственного препарата
Торговое наименование препарата
Международное непатентованное наименование
Лекарственная форма
концентрат для приготовления раствора для внутривенного введения
Состав
Название ингредиента
Кол-во
Функция компонента
Активное вещество
Норэпинефрина гидротартрата моногидрат в пересчете на безводное вещество
Вспомогательные вещества
Натрия гидроксид или
Каждый мл концентрата Норадреналина для приготовления раствора для внутривенного введения 1 мг/мл содержит 1 мг норэпинефрина гидротартрата, что эквивалентно 0,5 мг норэпинефрина основания.
Каждый мл концентрата Норадреналина для приготовления раствора для внутривенного введения 2 мг/мл содержит 2 мг норэпинефрина гидротартрата, что эквивалентно 1 мг норэпинефрина основания.
Описание
Фармакотерапевтическая группа
Код АТХ
Фармакодинамика:
Норэпинефрин является биогенным амином нейромедиатором.
Оказывает мощное стимулирующее действие на α-адренорецепторы и умеренно стимулирующее на ß1-адренорецепторы.
Попадая в кровь даже в малых концентрациях вызывает генерализованную вазоконстрикцию за исключением коронарных сосудов которые за счет непрямого действия расширяются (вследствие увеличения потребления кислорода) что приводит к повышению силы и (в отсутствие ваготонии) частоты сокращения миокарда увеличивая ударный и минутный объем сердца. Вызывает повышение артериального давления (АД) как систолического так и диастолического повышает общее периферическое сопротивление сосудов (ОПСС) и центральное венозное давление.
Кардиотропное действие норэпинефрина связано с его стимулирующим влиянием на ß1- адренорецепторы сердца.
Фармакокинетика:
Распределение. Норэпинефрин быстро выводится из плазмы путем обратного захвата и метаболизма. Слабо проникает через гематоэнцефалический барьер.
Показания:
Противопоказания:
— выраженная гиперчувствительность к компонентам препарата;
— артериальная гипотензия вызванная гиповолемией (за исключением случаев когда норэпинефрин применяется для поддержания мозгового и коронарного кровотока до окончания терапии направленной на восполнение объема циркулирующей крови);
— проведение галотановой и циклопропановой общей анестезии (в связи с риском развития аритмий сердца);
— выраженная гипоксия и гиперкапния.
С осторожностью:
— выраженная левожелудочковая недостаточность острая сердечная недостаточность недавно перенесенный инфаркт миокарда стенокардия Принцметала;
— тромбоз коронарных брыжеечных или периферических сосудов (риск усугубления ишемии и увеличения зоны инфаркта) недостаточное кровообращение.
Беременность и лактация:
Норэпинефрин способен нарушать перфузию плаценты и вызывать брадикардию плода. Норэпинефрин может вызвать сокращение матки и привести к асфиксии плода на позднем сроке беременности.
Препарат норэпинефрина в период грудного вскармливания следует применять с осторожностью так как отсутствуют данные о его способности проникать в грудное молоко.
Применение препарата Норадреналин в период беременности возможно если ожидаемая польза для матери превышает возможный риск для плода.
Способ применения и дозы:
Вводят только внутривенно.
Индивидуальная доза препарата Норадреналин устанавливается врачом в зависимости от клинического состояния пациента.
Препарат Норадреналин необходимо вводить посредством устройств центрального венозного доступа с целью снизить риск экстравазации и последующего некроза тканей.
В обоих способах разведения конечная концентрация полученного раствора для внутривенного введения должна составлять 80 мг/л что эквивалентно 40 мг/л норэпинефрина основания.
— Перед началом или во время терапии необходима коррекция гиповолемии гипоксии ацидоза гиперкапнии.
— Норадреналин следует применять одновременно с надлежащим восполнением объема циркулирующей крови.
Длительность скорость введения и дозирование раствора Норадреналина определяются данными контроля сердечной деятельности и под обязательным врачебным контролем артериального давления (каждые 2 минуты до достижения нормотонии после каждые 5 минут в течение всей инфузии) чтобы избежать возникновения гипертензии.
терапию Норадреналином следует снижать поэтапно так как резкая отмена может привести к острой гипотензии.
Курс лечения может длиться от нескольких часов до 6 дней.
Необходимо остерегаться введения раствора норадреналина под кожу и в мышцы из-за опасности развития некрозов (См. Раздел «Особые указания»).
Побочные эффекты:
При быстром введении наблюдается: головная боль озноб охлаждение конечностей тахикардия.
Со стороны центральной нервной системы: тревога бессонница головная боль психотические состояния цефалгия слабость тремор спутанность сознания снижение внимания тошнота рвота анорексия.
Со стороны дыхательной системы: одышка боли в области грудины и средостения затруднение дыхания дыхательная недостаточность.
Со стороны мочевыделительной системы: задержка мочеиспускания.
Со стороны иммунной системы: при гиперчувствительности к одному из ингредиентов препарата возможны аллергические реакции и затруднение дыхания.
Местные реакции: раздражение в месте введения или развитие некроза (См. Раздел «Особые указания»).
Продолжительное введение вазопрессора для поддержания артериального давления при отсутствии восстановления объема циркулирующей крови может вызвать следующие побочные эффекты:
— тяжелый периферический и висцеральный ангиоспазм;
— снижение почечного кровотока;
— увеличение уровня лактата в сыворотке крови;
— снижение выработки мочи.
В случае гиперчувствительности: при применении высоких доз или обычных наблюдается выраженное повышение АД (сопровождающееся головной болью светобоязнью колющей загрудинной болью бледностью кожных покровов повышением потоотделения и рвотой); диспепсические явления.
Передозировка:
Могут наблюдаться спазмы сосудов кожи коллапс анурия выраженное повышение АД.
Лечение: При появлении дозозависимых симптомов передозировки по возможности следует уменьшить дозу препарата.
Взаимодействие:
При применении норэпинефрина одновременно с сердечными гликозидами хинидином трициклическими антидепрессантами возрастает риск развития аритмий.
Альфа-адреноблокаторы (доксазозин лабеталол феноксибензамин фентоламин празозин теразозин талазозин) и прочие лекарственные средства обладающие альфа-адреноблокирующей активностью (галоперидол локсапин фенотиазины тиоксантены) противодействуют сосудосуживающему действию.
Алкалоиды спорыньи или окситоцин могут усиливать вазопрессорный и сосудосуживающий эффекты.
Особые указания:
Не рекомендуется одновременный прием препарата Норадреналин и ингибиторов МАО имипраминового и триптилинового типа (риск развития выраженного и продолжительного повышения АД).
При длительном применении препарата может наблюдаться снижение плазменного объема (необходима коррекция во избежание возвратной гипотонии при отмене препарата).
Пожилые пациенты могут быть особенно чувствительны к воздействию норадреналина.
Во время вливания следует часто (каждые 2 минуты) проверять кровяное давление и скорость потока во избежание гипертензии.
Форма выпуска/дозировка:
концентрат для приготовления раствора для внутривенного введения
Упаковка:
По 1 или 2 упаковки (5 или 10 ампул) вместе с инструкцией по применению и ножом ампульным по ТУ 400-6-169-85 или скарификатором ампульным по ТУ 64-1-994-79 или по ТУ 9432-001-14783767-2003 помещают в пачку картонную. При упаковке ампул с насечками кольцами или точками надлома скарификаторы или ножи ампульные не вкладывают.
Условия хранения:
Хранить в защищенном от света месте при температуре не выше 25°С. Хранить в недоступном для детей месте.
Срок годности:
Не использовать препарат по истечении срока годности.
Условия отпуска
Производитель
Закрытое акционерное общество «ЭкоФармПлюс», 142211, Московская обл., г. Серпухов, ул. 1-я Московская, д.44, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Общество с ограниченной ответственностью «ЕСКО Фарма»
Сердечно-легочная реанимация у взрослых
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при п
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при последующей реабилитации. Самым уязвимым и при этом очень важным звеном является первичный реанимационный комплекс, проводимый на месте происшествия, поскольку через 3–5 мин после остановки кровообращения и дыхания при обычной температуре тела развиваются необратимые изменения головного мозга пострадавшего.
Возможны как первичная остановка дыхания, так и первичная остановка кровообращения. Выявление первичной остановки дыхания (инородные тела дыхательных путей, электротравма, утопление, поражение центральной нервной системы (ЦНС) и др.) маловероятно на догоспитальном этапе, так как к моменту прибытия бригады скорой помощи успевает развиться фибрилляция желудочков или асистолия.
Причиной первичной остановки кровообращения могут быть острый инфаркт миокарда, аритмия различного характера, электролитный дисбаланс, тромбоэмболия легочной артерии, разрыв и расслоение аневризмы аорты и т. д.
Различают три варианта прекращения сердечной деятельности: асистолия, фибрилляция и электромеханическая диссоциация. Асистолия может быть первичной или вторично развиться после фибрилляции желудочков. В первом случае шансов на успех реанимации больше, во втором, при истощении резервов миокарда, — меньше. Иногда изолинию на электрокардиограмме (ЭКГ) воспринимают как асистолию, но она может наблюдаться и при неисправности электрокардиографа, случайном отсоединении электродов, низкоамплитудной ЭКГ и т. п. Электромеханическая диссоциация характеризуется наличием электропродукции сердца, но отсутствием сокращения миокарда.
При фибрилляции возникают разрозненные, беспорядочные, неэффективные сокращения миокарда. И здесь имеют значение применение прекордиального удара и рано выполненная дефибрилляция.
Признаками остановки кровообращения являются: потеря сознания; отсутствие пульса на сонных артериях; остановка дыхания; судороги; расширение зрачков и отсутствие их реакции на свет; изменение цвета кожных покровов.
Для подтверждения остановки сердца достаточно наличие первых трех признаков.
Сердечно-легочная реанимация (СЛР) не показана, и ее можно не начинать в случаях: если установлено, что с момента остановки сердца (при нормальной температуре окружающей среды) прошло свыше 25 мин; больные заранее зафиксировали свой отказ от СЛР.
В иных случаях при оказании помощи на догоспитальном этапе СЛР начинается немедленно.
Поводом для прекращения СЛР является отсутствие признаков восстановления кровообращения и дыхания при использовании всех доступных методов СЛР в течение 30 мин.
СЛР на догоспитальном этапе
Она включает в себя элементарное поддержание жизни (по П. Сафару) или первичный реанимационный комплекс (по А. Зильберу):
Кроме того, производятся мероприятия (рис. 1) специализированного реанимационного комплекса (по А. Зильберу), включающего:
Восстановление проходимости дыхательных путей. При возникновении неотложных состояний проходимость дыхательных путей часто нарушается в результате западения языка, аспирации рвотными массами, кровью. Необходимо очистить ротоглотку и выполнить «тройной прием Сафара» — разогнуть голову в шейном отделе позвоночника; выдвинуть нижнюю челюсть вперед и вверх; открыть рот. Если невозможно исключить перелом шейного отдела позвоночника и разгибать голову нельзя, ограничиваются выдвижением челюсти и открытием рта.
Если зубной протез цел, его оставляют в полости рта, так как это сохраняет контур рта и облегчает проведение ИВЛ.
При обструкции дыхательных путей инородным телом пострадавшего укладывают на бок и производят 3–5 резких ударов нижней частью ладони в межлопаточной области, затем пальцем пытаются удалить инородное тело из ротоглотки. Если этот метод неэффективен, то выполняют прием Геймлиха: ладонь реаниматолога укладывается на живот между пупком и мечевидным отростком, вторую руку укладывают на первую и производят толчок снизу вверх по средней линии. После чего также пальцем пытаются удалить инородное тело из ротоглотки.
В связи с опасностью инфицирования реаниматолога при контакте со слизистой рта и носа, а также для повышения эффективности ИВЛ используется ряд приспособлений: устройство «ключ жизни»; пероральный воздуховод; трансназальный воздуховод; фаринго-трахеальный воздуховод; двухпросветный пищеводно-трахеальный воздуховод (комбитьюб); ларингеальная маска.
Большим шагом вперед явилось создание ларингеальной маски. Ларингеальный масочный воздуховод представляет собой интубационную трубку, которая не проходит через голосовую щель в трахею, а имеет на дистальном конце миниатюрную маску, которая надевается на гортань. Манжета, прилегающая к краю маски, раздувается вокруг гортани, обеспечивая герметичность по ларингеальному периметру. Ларенгеальная маска обладает множеством преимуществ, в том числе позволяет обойтись без разгибания головы в шейном отделе, если к этому имеются противопоказания.
Каждый врач скорой помощи должен уметь выполнять интубацию трахеи. Этот метод позволяет обеспечить оптимальную проходимость дыхательных путей, снизить вероятность регургитации при проведении комплекса реанимационных мероприятий, обеспечить более высокое внутрилегочное давление. Кроме того, через интубационную трубку можно вводить некоторые медикаменты.
ИВЛ. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента без или с применением специальных устройств. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, поэтому эффективнее ИВЛ атмосферным воздухом, либо кислородо-воздушной смесью. Каждое вдувание должно занимать 1–2 с, а частота дыхательных движений составлять 12–16 в минуту. Адекватность ИВЛ оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Бригадой скорой помощи обычно используются либо воздуховод, либо лицевая маска и мешок Амбу, либо интубация трахеи и мешок Амбу.
Непрямой массаж сердца. После остановки кровообращения в течение 20–30 мин в сердце сохраняются функции автоматизма и проводимости, что позволяет его «запустить». Основной целью массажа сердца является создание искусственного кровотока. За время проведения непрямого массажа сердца происходит сжатие не только сердца, но и легких, которые содержат большое количество крови. Этот механизм принято называть грудным насосом.
При проведении непрямого массажа сердца пациент должен находиться на твердой поверхности. Одна ладонь реаниматолога располагается на нижней трети грудины по средней линии, вторая упирается в тыльную поверхность первой. Время надавливания и отпускания — 1 с, интервал между компрессиями — 0,5–1 с. Грудина у взрослого должна «продавливаться» на 5–6 см. При выполнении каких-либо лечебных мероприятий перерыв в тракциях не должен превышать 5–10 сек. Критериями эффективности непрямого массажа сердца являются появление пульсовых толчков на сонных артериях, артериальное давление на уровне 60–70 мм рт. ст., изменение цвета кожных покровов.
Если помощь оказывает один реаниматолог, то на два вдувания воздуха выполняются 15 тракций, если работают два реаниматолога, то на одно вдувание воздуха осуществляется 5 тракций.
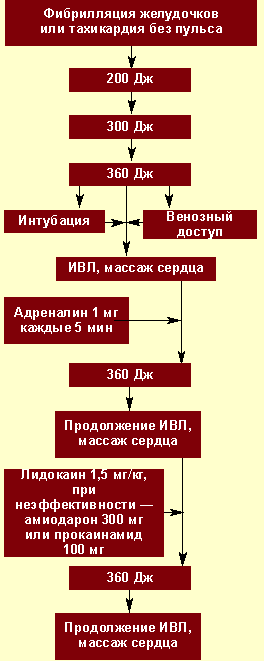 |
| Рисунок 2. Алгоритм неотложной помощи при фибрилляции желудочков |
Электрическая дефибрилляция сердца (ЭДС). Это важнейший компонент СРЛ. ЭДС эффективна только при сохранности энергетического ресурса миокарда, т. е. при регистрации на ЭКГ крупноволновых осцилляций от 0,5 до 1 мВ и более (рис. 2). Если же отмечаются низкие, аритмичные, полиморфные осцилляции, а также асистолия, то начинают с ИВЛ, непрямого массажа и медикаментозной терапии (рис. 3), добиваются перехода асистолии или мелковолновой фибрилляции желудочков в крупноволновую фибрилляцию и применяют ЭДС.
Первый разряд для ЭДС — 200 Дж, при неэффективности второй — 300 Дж, при неэффективности третий — 360 Дж. Перерыв между разрядами минимальный — для контроля ритма. Непрямой массаж сердца и ИВЛ прерываются только на момент разряда. Если первая серия из трех разрядов оказывается неэффективной, то на фоне продолжающейся ИВЛ, непрямого массажа сердца, медикаментозной терапии проводится вторая серия разрядов в той же последовательности.
В настоящее время на догоспитальном этапе применяются автоматические наружные дефибрилляторы, в этом случае ЭКГ регистрируется с электродов дефибриллятора, приложенных к грудной клетке. Дефибриллятор регистрирует ритм сердца и производит его автоматический анализ; при выявлении желудочковой тахикардии или фибрилляции желудочков конденсаторы автоматически заряжаются, и прибор дает разряд. Эффективность автоматических дефибрилляторов очень высока. Кроме автоматических, используются полуавтоматические наружные дефибрилляторы.
Медикаментозная терапия при сердечно-легочной реанимации. Медикаменты при СЛР могут вводиться: в периферическую вену; в центральную вену; в трахею.
По понятным причинам внутримышечный путь введения не показан. При наличии возможности катетеризируется периферическая вена. Если реаниматолог опытный и хорошо владеет методикой пункции центральной вены, можно использовать этот способ. Проблема в том, что в этом случае приходится прерывать реанимационные мероприятия, а перерыв больше, чем на 5–10 с нежелателен. Внутритрахеальный путь удобен, если выполнена интубация трахеи, в крайнем случае можно ввести препараты в трахею через перстнещитовидную мембрану. Эндотрахеально допустимо вводить адреналин, атропин, лидокаин. Препараты лучше развести в 10–20 мл 0,9% раствора натрия хлорида.
Адреналин остается средством выбора при остановке кровообращения. При асистолии и электромеханической диссоциации он «тонизирует» миокард и помогает «запустить» сердце, мелковолновую фибрилляцию переводит в крупноволновую, что облегчает ЭДС. Дозы: по 1–2 мг внутривенно струйно с интервалом 5 мин, суммарно обычно — до 10-15 мг.
М-холинолитик атропин снижает тормозящее влияние ацетилхолина на синусовый узел и атриовентрикулярную проводимость и, возможно, способствует высвобождению катехоламинов из мозгового слоя надпочечников. Он показан при брадисистолии и асистолии. Дозы — 1 мг, можно повторить через 5 мин, но не более 3 мг за время реанимации.
Все антиаритмические препараты оказывают депрессивное действие на миокард и небезвредны для организма пациента. При развившейся фибрилляции желудочков их следует вводить лишь в случае нескольких неудачных попыток ЭДС, поскольку они, подавляя желудочковую эктопию затрудняют восстановление самостоятельного ритма. Лидокаин считается одним из наиболее эффективных средств при рефрактерной фибрилляции желудочков, устойчивой желудочковой тахикардии и тахикардиях неясной этиологии с широким комплексом QRS. Доза для насыщающего внутривенного введения — 1,5 мг/кг струйно (обычно — 75–100 мг). Одновременно начинается введение поддерживающей дозы 2–4 мг в мин. Для этого 1 г лидокаина разводится в 250 мл 5% раствора глюкозы.
Показанием к введению гидрокарбоната натрия можно считать затянувшуюся более чем на 15 мин реанимацию, если остановке сердца предшествовали выраженный метаболический ацидоз или гиперкалиемия. Доза — 1 ммоль/кг, внутривенно однократно, при повторном введении она уменьшается вдвое. Некоторые авторы считают, что при адекватных реанимационных мероприятиях гидрокарбонат натрия следует вводить только под контролем кислотно-основного состояния, поскольку организм значительно хуже адаптируется к алкалозу, чем к ацидозу.
В качестве инфузионных растворов целесообразно использовать 0, 9% раствор хлорида натрия, но наиболее эффективен раствор лактата Рингера по Хартману, а из коллоидов — растворы со средней молекулярной массой, содержащие гидроксиэтилкрахмал — волювен или венофундин.
Во всех случаях показана экстренная госпитализация по витальным показаниям в отделение реанимации и интенсивной терапии.
И. Г. Труханова, доктор медицинских наук, доцент
Е. В. Двойникова, кандидат медицинских наук, доцент
Самарский государственный медицинский университет, Самара
Норадреналин в реанимации для чего
Проблема поражения легких при вирусной инфекции, вызванной COVID-19 является вызовом для всего медицинского сообщества, и особенно для врачей анестезиологов-реаниматологов. Связано это с тем, что больные, нуждающиеся в реанимационной помощи, по поводу развивающейся дыхательной недостаточности обладают целым рядом специфических особенностей. Больные, поступающие в ОРИТ с тяжелой дыхательной недостаточностью, как правило, старше 65 лет, страдают сопутствующей соматической патологией (диабет, ишемическая болезнь сердца, цереброваскулярная болезнь, неврологическая патология, гипертоническая болезнь, онкологические заболевания, гематологические заболевания, хронические вирусные заболевания, нарушения в системе свертывания крови). Все эти факторы говорят о том, что больные поступающие в отделение реанимации по показаниям относятся к категории тяжелых или крайне тяжелых пациентов. Фактически такие пациенты имеют ОРДС от легкой степени тяжести до тяжелой.
В терапии классического ОРДС принято использовать ступенчатый подход к выбору респираторной терапии. Простая схема выглядит следующим образом: низкопоточная кислородотерапия – высокопоточная кислородотерапия или НИМВЛ – инвазивная ИВЛ. Выбор того или иного метода респираторной терапии основан на степени тяжести ОРДС. Существует много утвержденных шкал для оценки тяжести ОРДС. На наш взгляд в клинической практике можно считать удобной и применимой «Берлинскую дефиницую ОРДС».
Общемировая практика свидетельствует о крайне большом проценте летальных исходов связанных с вирусной инфекцией вызванной COVID-19 при использовании инвазивной ИВЛ (до 85-90%). На наш взгляд данный факт связан не с самим методом искусственной вентиляции легких, а с крайне тяжелым состоянием пациентов и особенностями течения заболевания COVID-19.
Тяжесть пациентов, которым проводится инвазивная ИВЛ обусловлена большим объемом поражения легочной ткани (как правило более 75%), а также возникающей суперинфекцией при проведении длительной искусственной вентиляции.
Собственный опыт показывает, что процесс репарации легочной ткани при COVID происходит к 10-14 дню заболевания. С этим связана необходимость длительной искусственной вентиляции легких. В анестезиологии-реаниматологии одним из критериев перевода на спонтанное дыхание и экстубации служит стойкое сохранение индекса оксигенации более 200 мм рт. ст. при условии, что используются невысокие значения ПДКВ (не более 5-6 см. вод. ст.), низкие значения поддерживающего инспираторного давления (не более 15 см. вод. ст.), сохраняются стабильные показатели податливости легочной ткани (статический комплайнс более 50 мл/мбар), имеется достаточное инспираторное усилие пациента ( p 0.1 более 2.)
Достижение адекватных параметров газообмена, легочной механики и адекватного спонтанного дыхания является сложной задачей, при условии ограниченной дыхательной поверхности легких.
При этом задача поддержания адекватных параметров вентиляции усугубляется присоединением вторичной бактериальной инфекции легких, что увеличивает объем поражения легочной ткани. Известно, что при проведении инвазинвой ИВЛ более 2 суток возникает крайне высокий риск возникновения нозокомиальной пневмонии. Кроме того, у больных с COVID и «цитокиновым штормом» применяются ингибиторы интерлейкина, которые являются выраженными иммунодепрессантами, что в несколько раз увеличивает риск возникновения вторичной бактериальной пневмонии.
В условиях субтотального или тотального поражения дыхательной поверхности легких процент успеха терапии дыхательной недостаточности является крайне низким.
Собственный опыт показывает, что выживаемость пациентов на инвазивной ИВЛ составляет 15.3 % на текущий момент времени.
Алгоритм безопасности и успешности ИВЛ включает:
В связи с тем, что процент выживаемости пациентов при использовании инвазивной ИВЛ остается крайне низким возрастает интерес к использованию неинвазивной искусственной вентиляции легких. Неинвазивную ИВЛ по современным представлениям целесообразно использовать при ОРДС легкой степени тяжести. В условиях пандемии и дефицита реанимационных коек процент пациентов с тяжелой формой ОРДС преобладает над легкой формой.
Тем не менее, в нашей клинической практике у 23% пациентов ОРИТ в качестве стартовой терапии ДН и ОРДС применялась неинвазивная масочная вентиляция (НИМВЛ). К применению НИМВЛ есть ряд ограничений: больной должен быть в ясном сознании, должен сотрудничать с персоналом. Допустимо использовать легкую седацию с целью обеспечения максимального комфорта пациента.
Критериями неэффективности НИМВЛ являются сохранение индекса оксигенации ниже 100 мм рт.ст., отсутствие герметичности дыхательного контура, возбуждение и дезориентация пациента, невозможность синхронизации пациента с респиратором, травмы головы и шеи, отсутствие сознания, отсутствие собственного дыхания. ЧДД более 35/мин.
В нашей практике успешность НИМВЛ составила 11.1 %. Зав. ОАИР: к.м.н. Груздев К.А.