Но шпа уколы или таблетки что эффективнее
Таблетки, уколы или капли: что выбрать?
Одни и те же препараты часто выпускают в разных формах и в них легко запутаться. Рассказываем, в чем между ними разница и почему «прокапаться» не всегда полезнее, чем принять лекарство.
Как действуют препараты
Основная задача фармакологии — создание удобных для приема лекарств с максимальной эффективностью и минимальными побочными действиями. Идеальный вариант — это лекарство, которое действует точечно и не влияет на остальной организм. Чтобы этого добиться, в разных случаях и нужны разные формы выпуска лекарственных средств.
Для определения правильной работы препарата в фармакологии есть два понятия: биодоступность и период полувыведения.
Биодоступность — количество вещества, которое достигло цели назначения. Этому процессу мешают защитные барьеры организма. От биодоступности зависит подбор дозы для лечения и способ введения.
Период полувыведения — это время через которое уровень лекарства снижается вдвое от первоначального и перестает активно влиять на организм. Именно от этого периода зависит сколько раз в сутки нужно принимать лекарство.
Почему формы разные
Изначально было только два способа доставить лекарство в организм: проглотить или приложить, другие варианты медикам прошлого были недоступны.
Но с развитием медицины стало ясно, что эти варианты не всегда работают. При проглатывании препарат должен пройти долгий путь. Прежде чем попасть в нужное место, таблетка проходит через агрессивную среду желудка. А после всасывания, с током крови вещества попадают в печень, где обезвреживаются токсины и лекарство может стать неактивным до того как достигнет органа-мишени.
Также некоторые препараты могут негативно сказаться на работе желудочно-кишечного тракта. Вызвать тошноту, рвоту или просто не сработать, если желудок или кишечник не в порядке и нарушено всасывание.
«Классический пример, когда мы меняли препарат у пациента, — рассказывает терапевт GMS Clinic Андрей Беседин, — при обострениях язвенной болезни желудка, двенадцатиперстной кишки или после операции на желудочно-кишечном тракте. В этом случае лучше выбирать внутримышечные или внутривенные введения»
Есть ситуации, когда необходимо вводить лекарства внутривенно. Чаще всего это связано со срочностью, но есть препараты, которые разрушаются в желудочно-кишечном тракте. Например, некоторые антибиотики существуют только в виде инъекций и в этом случае без уколов не обойтись.
«Любая внутримышечная, подкожная, внутривенная инъекция — это маленькая операция, — поясняет Андрей Беседин, — во время которой мы нарушаем целостность организма, кожу, мышцы, в зависимости от того, что мы делаем. Поэтому если есть возможность, лучше использовать таблетки и капсулы».
Есть лекарства, которые оказывают серьезное действие на весь организм, если их принимать в виде таблеток или уколов. Для таких случаев изобрели местные формы. Так гормоны в кремах и назальном спрее полезны при кожных проявлениях и аллергическом насморке, но те же гормоны в больших дозах могут вызвать тяжелые последствия при длительном приеме таблеток или внутривенных инъекциях.
Для детей выпускают лекарства в виде жевательных таблеток, капель или таблеток уменьшенного размера, чтобы не превращать каждый прием лекарства в сражении или не вызывать ассоциацию лечение — боль. К сожалению, не всегда такое возможно, особенно в детских больницах.
«В медицине нет однозначных догматов, — говорит Андрей Беседин, — в каждой ситуации мы выбираем тип введения препарата индивидуально, в зависимости от того, каких целей мы хотим достигнуть с конкретным больным».
От чего зависит выбор
Врач определяет форму приема, опираясь не только на те препараты, которые доступны. Он обращает внимание на возраст, пол, финансовые возможности пациента и даже на его настрой и отношение к лечению. Особенного внимания требуют дети.
«Выбор формы препарата — это отчасти творческий процесс, — рассказывает терапевт клиники „120 на 80“ Екатерина Бокова, — здесь нет готовых решений. Но чаще всего ориентируемся на возраст. Если это совсем малыш, то мы выбираем жидкие или ректальные формы, чтобы исключить выплевывание и поперхивание. Так ребенок с большей гарантией получит свою дозу активного вещества. Иногда даже приходится делать выбор в пользу инъекционного препарата. В любом случае ребенку нельзя назначать „взрослые“ таблетки и делить их на части».
Пожелание пациента или родственников тоже имеет значение при выборе формы лекарства. Для пожилых людей важно, чтобы таблеток в день приходилось принимать меньше, иначе можно запутаться, особенно если лекарств много. В таких случаях помогают таблетницы или планировщики.
«К сожалению, обычно пожилые люди настаивают на назначении наиболее бюджетного препарата, — рассказывает Екатерина Бокова, — здесь, если есть возможность, мы идем навстречу».
Как выбрать подходящую форму
Даже лекарства с одинаковой формой приема могут отличаться друг от друга. Например, капсулы и таблетки.
«Капсулы дороже из-за разницы в технологиях, — объясняет Андрей Беседин. — Они скрывают неприятный запах и вкус лекарственных препаратов, в отличие от таблеток. Капсулы попадают в организм: желудок, кишечник и растворяясь, высвобождают порошок, который гораздо быстрее всасывается. Но есть фактор, который многие мои пациенты не любят. Таблетки часто можно разделить пополам или на четыре части и иногда в экстренной ситуации достаточно половины дозы. В случае с капсулой так не получится, поэтому выбор делается в пользу таблеток».
Есть пациенты, которые уверены в том, что инъекции и капельницы намного полезнее таблеток и специально настаивают на такой форме лечения. Считается, что в этом случае лекарство попадает сразу в кровь и точно подействует. Хотя такой способ введения сложнее, болезненнее и чаще всего разницы в результате нет, если одно и то же лекарство есть в форме таблеток или в ампулах.
«Например, пациенты просят при головной боли ввести внутримышечные или внутривенные обезболивающие препараты, — говорит Андрей Беседин. — Такой тип введения не имеет никаких преимуществ по сравнению с пероральными формами: порошками, капсулами, таблетками, если пациент может принимать лекарства через рот. Как правило, инъекции эффективны, если у человека есть большая потеря жидкости или он по каким-то причинам не может пить сам».
Внутривенные и внутримышечные способы доставки полезнее в экстренных случаях при болезнях желудка или кишечника или в ситуации, когда лекарство разрушается в пищеварительном тракте, например, гепарин или инсулин.
Что эффективнее: таблетки или уколы?
Поделиться:
Дела давно ушедших дней
Фармакология — наука активно развивающаяся. За последние десятилетия ассортимент лекарств пополнился множеством препаратов, имеющих существенные, важные отличия от своих «прародителей». Сегодня даже трудно представить, что каких-то 50 лет назад в арсенале врачей было всего несколько антибиотиков.
При этом препараты в таблетированной форме, тот же ампициллин и феноксиметилпенициллин, имели массу недостатков. Их нужно было принимать по нескольку раз в день в строгом соответствии с приемом пищи, к тому же все они отличались крайне низкой биодоступностью, т. е. бóльшая часть действующего вещества выводилась, не оказывая фармакологического эффекта.
А вот у инъекционных антибиотиков, того же бензилпенициллина или ампициллина, этих минусов не было: коли на здоровье, минуя желудочно-кишечный тракт и не переживай ни о биодоступности, ни о еде. С тех пор и закрепилось в сознании и врачей, и пациентов мнение о великой и безусловной эффективности инъекций.
И хотя сегодня, в веке XXI, и ассортимент, и биодоступность пероральных (т. е. принимаемых per os, через рот) лекарств существенно изменились, накрепко засевший в головах потребителей и — чего уж там скрывать — некоторых докторов миф жив, в отличие от рок-н-ролла. А между тем «живучесть» легенды этой может не лучшим образом отражаться на состоянии пациентов.
Уколи меня нежно
Прежде всего, укол — это больно. Плюс голубовато-сизые шишки после процедуры могут еще несколько недель напоминать о травматичном лечении. Более того, в отличие от приема таблеток, внутримышечное введение препаратов может сопровождаться рядом других неприятных последствий, в том числе:
И, конечно же, нельзя не упомянуть о страхе перед медицинскими манипуляциями, который поселяется в сознании многих взрослых и почти всех детей, испытавших на себе все «прелести» лечения уколами. Уколами, которые во всем мире уже практически уступили место не менее эффективным пероральным препаратам.
Таблетка современная, доступная
Чтобы потребители смогли поверить и свыкнуться с посягающей на святое мыслью о не меньшей эффективности таблеток по сравнению с инъекциями, разумеется, необходимы доказательства. И они есть, просто не все знают об их существовании.
Итак, в ряде масштабных клинических исследований, проведенных в соответствии со всеми требованиями доказательной медицины, было продемонстрировано, что современные пероральные антибиотики не уступают по эффективности инъекционным формам. Биодоступность подавляющего большинства таблетированных антибактериальных препаратов не ниже, чем инъекций.
Клинически доказано, что внутримышечное введение такого «любимого» многими врачами цефтриаксона при инфекции мочевыводящих путей у детей так же эффективно, как и прием внутрь комбинации триметоприма и сульфометоксазола (Бисептол). Скорость выздоровления и риск рецидивов при среднем отите у детей абсолютно одинаковы, независимо от того, колют ли ребенку тот же цефтриаксон или поят его сладкими детскими формами амоксициллина.
Ведущие международные организации здравоохранения утверждают: нет никакого смысла лечить пневмонию амбулаторно с помощью инъекций. Таблетки справятся с задачей не хуже! Также вовсе не обязательно назначать инъекционные антибиотики при синусите и большинстве внебольничных инфекций.
Отдавать предпочтения антибактериальным препаратам в инъекциях имеет смысл лишь в исключительных случаях, среди которых:
Сравнение эффективности таблеток и инъекций проводились не только в отношении антибактериальных препаратов.
Результаты исследований убедительно свидетельствуют, что результат лечения гормональными препаратами, витаминами группы В, в частности витамином В12, некоторыми нестероидными противовоспалительными препаратами, в том числе популярным анальгетиком кеторолаком, и многими другими лекарствами в таблетках и уколах идентичен. Но следует отметить, что иногда действительно без инъекций не обойтись.
Исключения из правил
Читайте также:
Анализ крови у детей и прививки
Случаев, когда назначение травматичного лечения оправдано, не так много. Перечислим их:
Во всех остальных ситуациях инъекционные лекарства должны уступить место менее болезненному способу введения — пероральным таблеткам или сиропам. И если ваш врач по старинке назначает вам уколы, имеет смысл поинтересоваться, нельзя ли заменить их на таблетки, сиропы или суспензии, которым отдают предпочтение во всех цивилизованных странах.
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Боль в животе, или абдоминальная боль, как правило, отражает патологический процесс в брюшной полости. По своей продолжительности она может быть острой или хронической. По механизмам возникновения можно различить следующие разновидности абдоминальной боли:
Так, при заболеваниях пищевода, желудка, двенадцатиперстной кишки наблюдается боль в эпигастральной области. Однако при инфаркте миокарда, нижнедолевой пневмонии, плеврите, остром пиелонефрите может наблюдаться сходная локализация болей.
При заболеваниях желчевыводящих путей, желчного пузыря и печени боль чаще всего отмечается в правом подреберье; при панкреатите – нередко локализуется в левом подреберье (следует помнить о том, что боли в правом или левом подреберье сопровождают также нижнедолевую плевропневмонию, почечную колику, инфаркт селезенки).
Боли в околопупочной области характерны для заболеваний тонкой кишки, а также могут быть связаны с поражением сосудов, например, аневризмой брюшного отдела аорты или нарушением мезентериального кровообращения.
Боли в правой подвздошной области обычно связаны с заболеванием слепой кишки и аппендикса. Такие боли также могут сопровождать патологию мочеточника.
Боли в левой подвздошной области, как правило, обусловлены патологией сигмовидной кишки, нередко – дивертикулитом.
Боли в надлобковой области в большинстве случаев бывают вызваны патологическими процессами в мочевом пузыре, матке и ее придатках.
Помимо устранения боли, очень важным является расслабление спазма. Спазм – патологическое или физиологическое сокращение отдельных мышц или групп мышц (а иногда многих групп мышц) является сопровождающим симптомом многих заболеваний. Он ухудшает кровоснабжение затронутой территории, а также сам по себе может явиться началом развития патологического состояния.
Как известно, состояние сократительного аппарата мышечной клетки находится в прямой зависимости от концентрации ионов кальция в цитоплазме. Последние, взаимодействуя с цитоплазматическим кальций–связывающим белком кальмодулином, активируют киназу легких цепей миозина. Киназа отщепляет фосфорный остаток от молекулы аденозинтрифосфорной кислоты, связанной с волокнами двигательного белка миозина. Благодаря этому миозин приобретает способность к взаимодействию с другим двигательным белком – актином. Между актином и миозином устанавливаются активные «молекулярные» мостики, благодаря которым актин и миозин «сдвигаются» по отношению друг к другу, что приводит к укорочению клетки.
Молекулы циклического аденозинмонофосфата (цАМФ) и циклического гуанозинмонофосфата (цГМФ) снижают содержание ионов кальция в цитоплазме и тем самым способствуют понижению сократительной активности клетки.
Циклические формы АМФ и ГМФ образуются из неактивных монофосфатов. Фермент фосфодиэстераза катализирует распад циклического АМФ и ГМФ до неактивных форм. Таким образом, одним из необходимых условий сокращения мышечного волокна является высокая активность фосфодиэстеразы, для расслабления – наоборот, нужна ее низкая активность.
Каковы возможности терапевтического купирования и предупреждения приступов абдоминальной боли?
Сегодня применяются лекарственные препараты следующих групп: нитраты, антихолинергические средства, антагонисты кальция, b –агонисты, применяющиеся в терапии бронхиальной астмы и миотропные спазмолитики – наиболее эффективная группа при абдоминальной боли, вызванной спазмом.
Основной спектр использования спазмолитиков в повседневной практике:
Механизм действия спазмолитиков
В зависимости от механизмов действия спазмолитики делятся на две группы: нейротропные и миотропные.
Нейротропные спазмолитики действуют путем нарушения передачи нервных импульсов в вегетативных ганглиях или нервных окончаниях, стимулирующих гладкие мышцы. Миотропные спазмолитики уменьшают мышечный тонус за счет прямого воздействия на биохимические внутриклеточные процессы.
Важнейшими нейротропными спазмолитиками являются М–холиноблокаторы.
М–холиноблокаторы (атропиноподобные средства) оказывают спазмолитическое действие в верхних отделах желудочно–кишечного тракта (ЖКТ): они в 3 –10 раз эффективнее влияют на желудок, чем на толстую кишку. Во–первых, это связано с неодинаковой плотностью распределения М–холинорецепторов в ЖКТ (наибольшее их количество находится в желудке). Далее в порядке убывания идет толстая, прямая, слепая, тощая и двенадцатиперстная кишка. Во–вторых, тонус стенки толстой кишки регулируется сакральным парасимпатическим нервом, резистентным к действию антихолинергических средств. Кроме того, лишь 20–40% сокращений мускулатуры толстой кишки осуществляется через М–холинорецепторы. Большая часть сокращений активируется нехолинергическими медиаторами. Это объясняет ограниченную эффективность антихолинергических средств при спастических явлениях в нижних отделах ЖКТ.
К побочным действиям М–холиноблокаторов относится снижение секреции различных экзокринных желез (слюнных, слизистых, потовых), НСl в желудке, увеличение ЧСС, мидриаз, паралич аккомодации и повышение внутриглазного давления.
М–холиноблокирующие средства по химическому строению делятся на третичные, проникающие через гематоэнцефалический барьер и оказывающие центральное действие (атропин, скополамин, платифиллин), и четвертичные аммониевые соединения, не проникающие через гематоэнцефалический барьер (метацин, хлорозил).
Количество побочных эффектов и невысокая спазмолитическая активность делают применение атропиноподобных средств весьма ограниченным.
Первыми по–настоящему эффективными миотропными спазмолитическими препаратами были экстракты опия. Дальнейшему развитию их применения послужило знание того, что среди алкалоидов опия папаверин является тем препаратом, который обладает наиболее выраженным спазмолитическим действием на гладкую мускулатуру и наименьшим влиянием на ЦНС. Производство препарата в промышленных объемах в виде солянокислой соли было осуществлено в 1930 г. на заводе «Хиноин». В 1931 году путем замещения метокси–групп папаверина этокси–радикалами был разработан препарат перпарин с более сильным спазмолитическим эффектом, чем папаверин, но меньшей всасываемостью. Продолжались исследования с целью получения более эффективного миотропного спазмолитика, чем папаверин, и, по возможности, не обладающего побочными эффектами. Наконец, в 1961 г. Meszaros, Szentmiklosi и Czibula разработали гидрированные производные папаверина, а именно – дротаверин, получивший торговое название «Но–шпа». Все фармакологические и клинические исследования доказали более высокую эффективность дротаверина в сравнении с папаверином.
Миотропные спазмолитики проявляют определенный тропизм к отдельным гладкомышечным органам. Среди них выделяют бронхолитики, вазодилататоры, желудочно–кишечные спазмолитики. Они понижают тонус гладкомышечных клеток путем прямого влияния на биохимические внутриклеточные процессы, либо приводят к увеличению внутриклеточного цАМФ или к уменьшению внутриклеточного цГМФ. цАМФ активирует выход ионов Са 2+ из клетки и его депонирование, что приводит к снижению сократительной способности клетки. цГМФ, напротив, увеличивает сократимость гладкомышечной клетки вследствие стимуляции выхода ионов Са 2+ из внутриклеточных депо.
К спазмолитикам миотропного действия относятся также антагонисты кальция.
Действие антагонистов кальция связано с блокированием медленных потенциал–зависимых Са 2+ –каналов в гладкой мускулатуре ЖКТ. Эти препараты слабо влияют на рецептор–зависимые Са 2+ –каналы и не могут блокировать выход Са 2+ из депо, поэтому оказывают спазмолитическое действие преимущественно в верхних отделах ЖКТ.
Механизм действия дротаверина
Аденозин 3’–5’–цикломонофосфат (цАМФ) и гуанозин 3’–5’–цикломонофосфат (цГМФ) играют важную роль в регуляции тонуса гладкомышечных клеток. Увеличение концентрации этих веществ напрямую связано с релаксацией мускулатуры.
Внутриклеточная концентрация циклических нуклеотидов определяется относительной скоростью их образования с помощью агонист–индуцируемой стимуляции аденилатциклазы (агонист – норадреналин) и гуанилатциклазы (агонист – ацетилхолин), а также скоростью их гидролиза фосфодиэстеразными ферментами клеток (ФДЭ).
цАМФ и цГМФ синтезируются из соответствующих нуклеозидтрифосфатов при помощи мембранносвязанных ферментов аденилатциклазы и гуанилатциклазы, соответственно, цАМФ и цГМФ инактивируются ФДЭ до неактивных нециклических рибозофосфатов.
Аденилатциклазная система универсальна, а цАМФ и цГМФ – это важнейшие внутриклеточные вторичные мессенджеры для гладкомышечных клеток различных органов (гладкая мускулатура ЖКТ, трахеи, бронхов, матки, мочеточников, сосудов, миокарда), а также для клеток других тканей (тромбоциты, лимфоциты, секреторные клетки, ЦНС и т.д.). Система обеспечивает различные функции (тонус мышц, секреция, агрегация и т.д.). Большая широта функций аденилатциклазной системы обеспечивается существованием многочисленных изоферментов ФДЭ в различных видах тканей (тканеспецифические и видоспецифические). Изоферменты ФДЭ отличаются по физическим и кинетическим характеристикам, субстратной (цАМФ или цГМФ) специфичности, чувствительности к эндогенным активаторам и ингибиторам, чувствительности к фосфорилированию с помощью протеинкиназ, распределению в тканях и локализации в клетке. Так, различия во внутриклеточном распределении изоферментов ФДЭ являются важным фактором, определяющим их индивидуальную регуляторную роль. По данным серии экспериментальных исследований установлено около 7 различных семейств ФДЭ: Ca 2+ –кальмодулин–зависимые (ФДЭ I), цГМФ–стимулируемые (ФДЭ II), ц–ГМФ–ингибируемые (ФДЭ III), цАМФ–специфические (ФДЭ IV), цГМФ–специфические (ФДЭ V), фотоспецифические (ФДЭ VI), высокоаффинные (устойчивые) (ФДЭ VII).
Таким образом, ФДЭ играет основную роль в регуляции тонуса гладкой мускулатуры и представляет собой удобную клеточную мишень для разработки лекарственных препаратов.
ФДЭ, выделенные из различных тканей, содержат все изоферменты, но в разных количествах. В экспериментальных исследованиях были установлены наиболее значимые типы ФДЭ в разных тканях и созданы селективные ингибиторы ФДЭ. Так, известен селективный ингибитор ФДЭ III милринон, селективный ингибитор ФДЭ IV ролипрам, селективный ингибитор ФДЭ V запринаст. Милринон является некатехоламиновым инотропным средством для кардиомиоцитов и вызывает релаксацию гладкой мускулатуры сосудов; ролипрам, по первоначальным данным, являлся ингибитором ФДЭ мозга, а затем его эффект был показан на ФДЭ IV мускулатуры дыхательных путей, клетках печени, лимфоцитов. Результаты исследований показали, что гладкая мускулатура толстого кишечника содержит почти все изоформы ФДЭ, основное значение среди которых имеет ФДЭ IV.
В гладкомышечных клетках мочевыводящих путей обнаружено существование, по крайней мере, трех различных изоформ (I, II, IV), однако также преобладает ФДЭ IV.
Миометрий при беременности содержит большие дозы ФДЭ IV (50%) и ФДЭ III (10%). ФДЭ IV содержится как в начальном периоде беременности, так и в последнем триместре. Предполагается, что ФДЭ IV в конце беременности способствует (через изменение уровня цАМФ) подготовке миометрия к родами. Исследования на изолированной матке показали, что селективные ингибиторы ФДЭ IV могут снижать чувствительность органа к окситоцину и приводить к быстрому расслаблению матки после применения максимальной концентрации окситоцина. Этот феномен может быть использован при преждевременных родах.
Дротаверин и его главные метаболиты (СН 280895 и СН 281095) являются сильными и селективными ингибиторами ФДЭ IV гладкомышечных клеток. Благодаря эффектам дротаверина обеспечивается не только спазмолитический эффект, но и уменьшается отек и воспаление, в патогенезе которых также участвует ФДЭ IV.
Действие в качестве антагониста кальция
Другой класс антагонистов Ca 2+ представляют собой препараты, которые взаимодействуют с кальмодулином, цитоплазматическим Ca 2+ –модулирующим белком. Кальмодулин функционирует, как необходимый медиатор действия ионов Ca 2+ в Ca 2+ –зависимых внутриклеточных процессах: при увеличении концентрации ионов Ca 2+ в стимулированной клетке кальмодулин связывает их, что приводит к конформационному изменению молекулы кальмодулина, и она приобретает способность связываться актин–миозиновой сократительной системой.
Эффект блокирования натриевых каналов
Натриевые каналы играют фундаментальную роль в образовании и проведении электрических стимулов и могут быть вовлечены в патогенез многих заболеваний. На натриевых каналах идентифицированы участки связывания для лекарственных препаратов. Блокаторы Na + –каналов широко используются, как антиаритмические, противоэпилептические и местные анестизирующие средства. В экспериментальных исследованиях показано наличие у дротаверина сродства по отношению к Na + –каналам; его активность к Na + –каналам в 10 раз выше, чем к Ca 2+ –каналам.
Ингибиторы ФДЭ III могут быть причиной аритмий, возникающих из–за повышения уровня внутриклеточной цАМФ и, следовательно, увеличения уровня Са 2+ в кардиомиоцитах. Не только ингибиторы ФДЭ III, но и ФДЭ V обладают выраженным кардиоваскулярным эффектом.
Пик концентрации дротаверина в плазме наступает между 45 и 60 минутами после приема, что характеризует его, как быстро всасывающийся препарат. После однократного перорального приема 80 мг дротаверина гидрохлорида максимальная концентрация в плазме исходного соединения (136–320 нг/мл) достигается через 2 часа. Биодоступность дротаверина при приеме внутрь составляет 60%.
Дротаверин связывается с белками плазмы (95–98%), особенно с альбумином, b – и g –фракциями глобулинов и a –липопротеинами.
Препарат хорошо проникает в различные ткани: ЦНС, жировую ткань, миокард, легкие, почки, печень, стенку мочевого и желчного пузыря, кишки, сосудистую стенку.
Период полувыведения составляет 16 часов. Около 60% дротаверина при пероральном приеме выделяется через ЖКТ и до 25% с мочой.
Главный путь метаболизма дротаверина – окисление. Препарат метаболизируется почти полностью до монофенольных соединений. Его метаболиты быстро конъюгируются с глюкуроновой кислотой.
Многие симптомы, с которыми встречаются терапевты и гастроэнтерологи, объясняются расстройством сокращения гладкой мускулатуры ЖКТ. Симптомы спастической дисфункции ЖКТ встречаются почти у 30% здоровых людей. Большая часть пациентов, обращающихся за консультацией к врачу, страдает различными функциональными расстройствами ЖКТ. В первую очередь, это – неязвенная диспепсия и синдром раздраженной кишки. Понимание патофизиологии висцерального спазма может облегчить рациональный подход к лечению. Дротаверин эффективен при лечении различных желудочно–кишечных заболеваний, характеризующихся спазмом гладкой мускулатуры.
Лекарственные формы дротаверина (Но–шпы)
1 ампула Но–шпы (2 мл) содержит 40 мг дротаверина
1 таблетка Но–шпы содержит 40 мг дротаверина
1 таблетка Но–шпы форте содержит 80 мг дротаверина
Спазм гладкой мускулатуры пищевода
Основными симптомами, связанными со спастической дисфункцией пищевода, являются дисфагия и боль в грудной клетке.
Дисфагия – ощущение замедления или препятствия при продвижении пищи по глотке и пищеводу в желудок.
Функциональная дисфагия развивается из–за нарушения акта глотания и снижения перистальтической активности пищевода вследствие патологии поперечно–полосатой и гладкой его мускулатуры. Наиболее значимые заболевания этой группы – ахалазия, диффузный спазм пищевода и желудочно–пищеводный рефлюкс.
Боли в грудной клетке при заболеваниях ЖКТ носят спастический характер, отличаются высокой интенсивностью, локализуются в области средней трети грудины и нередко иррадиируют в область передней поверхности грудной клетки. Возникают такие боли при гипермоторной дискинезии грудного отдела пищевода (эзофагоспазме) и являются следствием нарушения перистальтической функции гладких мышц его стенки. Боли могут появиться как во время еды, так и в любой другой момент.
Для лечения дисфагии и болей, связанных со спастической дисфункцией пищевода, применяют нитраты, антихолинергические препараты, спазмолитики из группы ингибиторов фосфодиэстеразы и антагонистов кальция (дротаверин). Они приводят к уменьшению давления в пищеводе. Однако ни один препарат при монотерапии не обеспечивает полную эффективность в лечении спастических расстройств пищевода.
Термином «неязвенная диспепсия» обозначают симптомокомплекс, включающий в себя жалобы на боли в подложечной области, ощущение тяжести и переполнения в эпигастрии после еды, раннее насыщение, тошноту и рвоту, отрыжку воздухом, изжогу, срыгивание и т.д. Синонимы данного термина – функциональная, идиопатическая, неорганическая диспепсия. В процессе тщательного обследования не удается выявить какое–либо органическое заболевание (язвенную болезнь, рефлюкс–эзофагит, рак желудка и т.д.). Распространенность диспептических жалоб среди населения очень высока – от 19 до 41% у разных авторов, при этом от трети до половины всех случаев диспептических расстройств приходится на долю функциональной диспепсии.
В зависимости от основных клинических симптомов выделяют четыре варианта неязвенной диспепсии: язвенноподобный, рефлюксоподобный, дискинетический и неспецифический.
Ведущее место в патогенезе неязвенной диспепсии отводится нарушениям моторики верхних отделов ЖКТ.
Лечение пациентов включает здоровый образ жизни, предупреждение инфицированности пилорическим геликобактером, использование антацидов и спазмолитиков при язвенноподобном варианте (особенно при выявлении пилороспазма и гипермоторной дискинезии двенадцатиперстной кишки). При рефлюксоподобном и дискинетическом вариантах применяются прокинетики.
Дисфункция сфинктера Одди
Для описания этого функционального расстройства со стороны желчных путей было использовано множество других терминов: дискинезия желчевыводящих путей, гипертоническая дискинезия сфинктера Одди, спазм сфинктера Одди, сосочковая дисфункция.
Нарушения и механизм развития боли при дисфункции сфинктера Одди заключается в развитии спазма сфинктерных мышечных волокон и повышении давления в системе желчных и/или панкреатических протоков.
Факторы, вызывающие длительные спазмы сфинктера Одди, неизвестны.
С лечебной целью наиболее часто в практике используются миотропные спазмолитики, оказывающие целенаправленное воздействие на гладкие миоциты желудочно–кишечного тракта.
Основными представителями данной группы препаратов являются дротаверин (Но–шпа, Но–шпа форте), отилония бромид и др. Данные препараты используются кратковременно (от однократного приема до двух–трех недель) для купирования спазма, а следовательно, болевого синдрома.
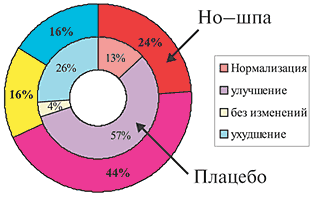
В двойном слепом плацебо–контролируемом клиническом исследовании изучалась эффективность Но–шпы у больных со стенозом сфинктера Одди в качестве вспомогательного средства, в том числе у больных с хирургическими вмешательствами. Применение Но–шпы показало достоверное значительное уменьшение болевого синдрома у 60% больных и небольшой эффект еще у 23%, тогда как плацебо в 55% случаев не влияло на интенсивность болевого синдрома. В этом исследовании Но–шпа оказалась в 2 раза более эффективной, чем анальгетики.
Кроме того, в пилотном исследовании было установлено, что применение Но–шпы на 15–60% снижает активность АСТ у больных с заболеваниями билиарной системы.
Результаты этих исследований показали, что Но–шпа является средством выбора при спазмах гладкой мускулатуры билиарной системы, Но–шпа может применяться как в монотерапии, так и в комбинации с антибиотиками и хирургическими методами лечения.
Синдром раздраженной кишки
Симптомы гипертонического нарушения моторики нижнего отдела желудочно–кишечного тракта включают запоры, с болями в нижней части живота или без них. Наиболее часто больным с такими симптомами ставят диагноз синдрома раздраженной кишки и хронического запора.
Синдром раздраженной кишки (СРК) – частая клиническая проблема, с которой встречаются врачи скорой помощи и гастроэнтерологи. СРК – одно из проявлений функциональных нарушений ЖКТ, при котором в патологический процесс вовлекается преимущественно толстая кишка. СРК характеризуется главным образом нарушениями моторной и секреторной функции толстой кишки без морфологических изменений в слизистой оболочке.
Эпидемиологические исследования указывают на высокую частоту заболевания в общей популяции: 14–24% женщин и 5–19% мужчин. СРК – это биопсихосоциальное нарушение, в котором отклонения психоэмоционального порядка, моторики и чувствительности приводят к болям в животе и расстройствам дефекации. Для оценки симптомов применяют унифицированный набор критериев, Римские диагностические критерии.
Принципы лечения СРК включают нормализацию режима и характера питания, нормализацию психоэмоциональной сферы, коррекцию двигательных расстройств толстой кишки. При СРК, протекающем преимущественно с болевыми ощущениями, оптимальным следует считать назначение лекарственных препаратов, оказывающих спазмолитическое действие (дротаверин, пинавериума бромид, бутилскополамин).
Было проведено несколько клинических исследований по оценке эффективности и переносимости Но–шпы у больных с синдромом раздраженной кишки и другими кишечными расстройствами.
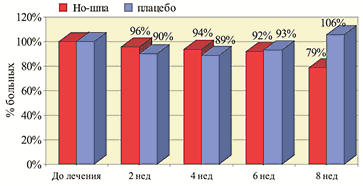
В двойном слепом рандомизированном исследовании с плацебо–контролем было включено 62 больных (возраст 50,8±14,2 года) с СРК и запором. Больные регистрировали свои жалобы ежедневно в течение 2 недель до начала лечения и в течение 8 недель лечения Но–шпой по 80 мг 3 раза в день или 2 таблетками плацебо 3 раза в день. Активное лечение достоверно снизило боль в животе на 47%, тогда как в группе плацебо боль усилилась на 3% (р Рис. 1. Частота болевого абдоминального синдрома на фоне приема Но-шпы и плацебо
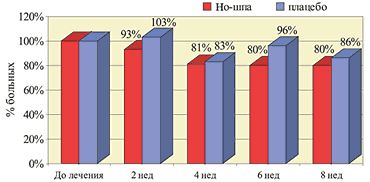
Рис. 2. Частота метеоризма на фоне приема Но-шпы и плацебо
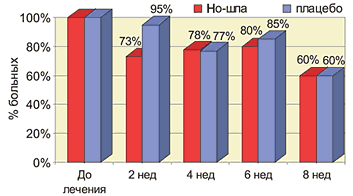
Рис. 3. Частота диспепсии на фоне приема Но-шпы и плацебо
Рис. 4. Частота запоров на фоне приема Но-шпы и плацебо
Рис. 5. Изменение времени пассажа в толстой кишке на фоне приема Но-шпы и плацебо
Запор является весьма распространенной жалобой. Запор могут вызвать различные факторы, поражающие гладкие или поперечно–полосатые мышцы, что нарушает функцию автономных или соматических нервов, или же факторы, связанные с изменением колоректальной анатомии или содержимого кишечника.
Запор является весьма распространенной жалобой. Запор могут вызвать различные факторы, поражающие гладкие или поперечно–полосатые мышцы, что нарушает функцию автономных или соматических нервов, или же факторы, связанные с изменением колоректальной анатомии или содержимого кишечника.
Среди заболеваний, являющихся причиной вторичных запоров, выделяют системные эндокринные и метаболические заболевания, нарушения и заболевания ЦНС (повреждения спинного мозга, периферических нервов), а также миопатию и миодистрофию. Запор может быть вызван приемом ряда лекарственных средств, относящихся к различным группам, включая препараты, взаимодействующие с нейронами ЦНС (например, опиаты), лекарства, прямо воздействующие на гладкие мышцы (антагонисты кальция), и препараты, изменяющие содержимое кишечника (холестирамин). Привычное потребление пищи с низким содержанием клетчатки может привести к редкому стулу и жалобам на запор.
В лечении запоров применяют диету с повышенным содержанием волокон и клетчатки, различные слабительные средства и лекарственные препараты, улучшающие нейромышечную регуляцию моторной функции толстой кишки (прокинетики) или спазмолитики. Препараты, активирующие кишечную моторику, в сочетании со спазмолитиками помогают избежать применения токсичных слабительных.
Боль – универсальный симптом при самых разнообразных поражениях желудочно–кишечного тракта, в основе ее возникновения часто лежит спазм гладкой мускулатуры органов брюшной полости. Из всей группы спазмолитических препаратов самым популярным на сегодняшний день является дротаверин (Но–шпа). Обзор результатов клинических исследований свидетельствует, что Но–шпа является эффективным препаратом для быстрого купирования спазмов и болей. Для быстрого начала эффекта первое введение Но–шпы должно быть внутривенным или внутримышечным, для длительного лечения – пероральное назначение.
1. Белоусов Ю. Б. Спазмолитические средства. Фарм. Вестник, 36 (235, 2001).
2. Белоусов Ю. Б., Леонова М. В. Клиническая фармакология но–шпы. Методическое пособие для врачей. М., 2002.
3. «Гастроэнтерология» Справочник. П/р В. Т. Ивашкина и С. И. Раппопорта. М., Русский врач, 1998, стр. 84–90
4. Григорьев П. Я., Яковенко Э. П., Прянишникова А. С. и соавт. Место препарата Но–шпа форте в ведении больных с абдоминальным болевым синдромом. Практикующий врач, 16 (3, 1999), стр.39–40
5. Ивашкин В. Т., Шульпекова Ю. О., Драпкина О. М. Абдоминальный болевой синдром. Сдана в печать в Российский журнал гастроэнтерологии, гепатологии и колопроктологии.
6. Леонова М. В., Шишкина Т. И., Белоусов Ю. Б. Новая лекарственная форма Но–шпа форте в клинической практике.
7. Akos Pap M.D. The management of smooth muscle spasm. Budapest, 1998, 266 p.
8. Blasko G. Pharmacology, mechanism of action and clinical significance of a convenient antispasmodic agent: drotaverine. JAMA India – The physician’s update, 1998, v.1,N 6, p.63–70.
9. Kapui Z., Bence J., Boronkay E. et al. Behavioural effects of selective PDE4 inhibitors in relation to inhibition of catalytic activity and competition for [3H]rolipram binding. Neurobiology, 1999, v.7, N 1, p.71–73.



 Читайте также:
Читайте также: