Нмг в гинекологии что это
Низкомолекулярные гепарины: возможности применения при беременности
Существует целый ряд заболеваний, результаты лечения которых трудно предсказуемы. Невынашивание беременности относится именно к таким заболеваниям, однако, непредсказуемость результатов лечения в случае этой патологии имеет особое драматическое значение.
Об эффективности применения низкомолекулярных гепаринов (НМГ) при невынашивании беременности мы беседуем с главным акушером-гинекологом ПФО, заведующей кафедрой акушерства и гинекологии № 1 ГБОУ ДПО КГМА Минздрава России, профессором Ларисой Ивановной Мальцевой.
— Что такое низкомолекулярные гепарины?
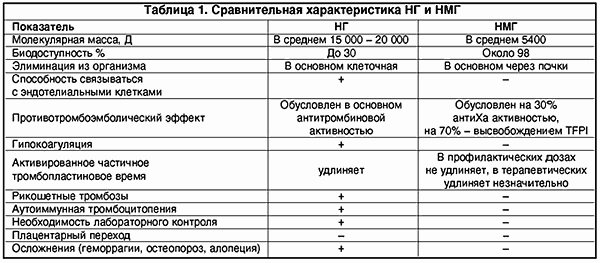
— Гепарин является основным препаратом прямого антикоагулянтного или антитромботического действия. Его эффекты опосредуются несколькими протеинами плазмы: антитромбином III, гепариновым кофактором II, TFPI (ингибитор внешнего пути свертывания). Обычный (нефракционированный) гепарин (НГ) является высокомолекулярным соединением, его молекулярная масса — 15-20 тысяч Да, при этом биодоступность составляет всего 30%. Это определено гетерогенностью структуры, способностью связываться с различными белками и клетками-макрофагами, клетками эндотелия и др. Кроме того, нефракционированнный гепарин подвержен влиянию антигепаринового фактора тромбоцитов, образуя с ним специфический комплекс, который может вызвать гепариновую иммунную тромбоцитопению и тромбоз. Большие дозы гепарина снижают уровень антитромбина III, что может вызвать гиперкоагуляцию и также стать причиной тромбоза. Таким образом, наряду с множеством плюсов обычный гепарин обладает рядом нежелательных эффектов, которых лишен низкомолекулярный гепарин (НМГ). НМГ имеет молекулярную массу в 3-4 раза меньшую, чем нефракционированный гепарин и 100% биодоступность, благодаря чему препараты этой группы дольше циркулируют в крови, обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Изменение структуры молекулы гепарина, то есть уменьшение молекулярной массы почти в три раза, повлекло за собой изменения в фармакодинамике и фармакокинетике препарата. Одно из важнейших качественных отличий НМГ от НГ — способность существенно не удлинять такие показатели как АЧТВ и ТВ, что связано преимущественно с воздействием на фактор Ха (а не на антитромбин III) и ингибицией внешнего пути свертывания. Меньшая зависимость НМГ от активности антитромбина III позволяет применять препараты НМГ у больных с дефицитом этого фактора. НМГ не вызывают гипокоагуляции и практически не требуют лабораторного контроля при своем использовании. В последнее время активно изучается способность НМГ блокировать системный воспалительный ответ, который является основой таких состояний в акушерстве, как преэклампсия, сепсис, антифосфолипидный синдром, невынашивание беременности. При невынашивании беременности препараты НМГ используются очень широко.
— С чем это связано?
— Дело в том, что более чем в 50% случаев, по некоторым данным, причиной невынашивания беременности являются различные формы тромбофилий, среди которых доминирует антифосфолипидный синдром (АФС). Его роль в невынашивании и недонашивании беременности доказана, и этот очевидный факт уже широко известен в акушерском сообществе. Основным средством лечения являются препараты НМГ. Другие причины невынашивани: острые и хронические инфекционные заболевания, генетические факторы, эндокринная патология, аномалии развития половых органов — имеют меньший удельный вес (особенно при привычном невынашивании), чем тромбофилии.
— Есть ли противопоказания к применению низкомолекулярных гепаринов?
В России зарегистрированы несколько препаратов НМГ, применяемых в акушерстве: надропарин, эноксипарин, дельтапарин. Противопоказанием для их применения являются наследственные или приобретенные тромбоцитопении и/или тромбоцитопатии, дефекты плазменного звена гемостаза — болезнь Виллебранда, носительство гемофилии А или В, редкие геморрагические дефекты (дефицит фактора V, V и VIII, VII, X, XI, XIII, II). Заподозрить патологию гемостаза можно при анализе анамнеза женщины: кровотечения после родов/абортов меноррагии, носовые, десневые кровотечения, при операциях, в т.ч. минимальных (тонзилэктомия, экстракция зуба и др.). Противопоказаны НМГ при кровотечении любого происхождения, высоком артериальном давлении, патологии печени с коагулопатией. В акушерском и гинекологическом отделениях РКБ № 2 широко применяются препараты НМГ для лечения невынашивания беременности и другой патологии, связанной с риском тромботических осложнений.
— Какие исследования в этом направлении ведутся на кафедре?
— Сфера научных интересов кафедры связана с оптимизацией лечения привычного невынашивания беременности, преждевременных родов и плацентарной недостаточности. Нами было установлено, что АФС часто сочетается с хроническими воспалительными заболеваниями половых органов: хроническим эндометритом, цервицитом, кольпитом. Антифосфолипидные антитела поддерживают воспалительный процесс, усиливая аутоиммунный компонент воспаления и не всегда НМГ могут снизить уровень воспалительного ответа. Отсюда, по нашему мнению, неэффективность лечения невынашивания в ряде случаев при доказанном АФС. Включение в комплекс лечения натурального прогестерона и аспирина в небольших дозах, а также обоснованной терапии иммуноглобулинами для внутривенного введения достоверно снижает уровень провоспалительных цитокинов, продуктов деградации фибрина, повышая эффективность лечения. Кроме того, различные препараты обладают неодинаковой противовоспалительной активностью. Исследования продолжаются.
Таким образом, созданные в 1995 году НМГ оказались практически незаменимыми препаратами при определенной патологии в акушерстве и гинекологии. Альтернативные методы лечения АФС при невынашивании беременности в виде плазмафереза, больших доз имунноглобулина для внутривенного введения, аспирина значительно уступают НМГ как по эффективности, так и по безопасности. Вместе с тем врач должен четко представлять себе, что применение НМГ требует навыков и четких знаний.
Применение низкомолекулярных гепаринов в акушерской практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
Д о настоящего времени тромбозы и тромбоэмболические осложнения остаются основной причиной смерти в большинстве развитых стран. Только в США от артериальных и венозных тромбозов ежегодно погибает около 2 млн человек и приблизительно такому же числу больных ежегодно удается пережить эпизоды глубоких венозных тромбозов, тромбоэмболий, цереброваскулярных тромбозов, транзиторных ишемических атак, коронарных тромбозов, тромбозов сетчатки и т.д. Даже от злокачественных новообразований погибает приблизительно в четыре раза меньше больных. Это свидетельствует о том, что тромбозы являются экстраординарной причиной заболеваемости и смертности населения, в том числе и материнской. По обобщенным данным мировой литературы, на 1000 родов приходится 2-5 тромботических осложнений. 50% всех венозных тробмоэмболических осложнений возникают у женщин в возрасте до 40 лет и, как правило, они связаны с беременностью.
| На 1000 родов приходится 2-5 случаев тромботических осложнений. |
Таким образом, тенденция к стазу крови в сочетании с гиперкоагуляцией создает условия, благоприятствующие повышенному риску тромбообразования.
Дополнительными факторами риска по тромботическим осложнениям могут служить возраст (старше 35 лет), сердечно-сосудистая патология, эндокринные нарушения, гестоз, заболевания почек, гнойно-септические заболевания, а также ряд острых состояний (отслойка плаценты, эмболия околоплодными водами, длительная задержка мертвого плода в матке и др.). Гиперкоагуляция сменяется внутрисосудистым свертыванием крови, проявляющимся различными формами синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Следует отметить, что расширение показаний к кесареву сечению также сопряжено с повышенным риском тромбоза вследствие хирургического вмешательства, значительного изменения метаболизма, травмы, попадания тромбопластических субстанций в кровоток, иммобилизации, замедления венозного кровотока и пр.
Особое место среди факторов риска по тромбоэмболическим осложнениям занимают гнойно-септические процессы в области малого таза, так как в патологический процесс вовлекаются подвздошные, яичниковые, маточные вены, что может осложниться бактериальной легочной эмболией. При этом повышенная концентрация высокодисперсных белков плазмы (в частности, фибриногена) дополнительно опосредует повышенную структурную гиперкоагуляцию.
За последнее десятилетие клиническая картина обогатилась возможностями выяснения ряда ранее не известных патогенетических форм тромбоза: иммунных, а также генетических или так называемых наследственных дефектов гемостаза, предрасполагающих к тромбозу.
К иммунным формам относят тромбоз, обусловленный гепарин-индуцированной тромбоцитопенией (ГИТ), тромбоз, связанный с циркуляцией антифосфолипидных антител при антифосфолипидном синдроме, а также сравнительно недавно открытую новую форму иммунного тромбоза, обусловленного аутоантителами к фактору Виллебранда. При всех иммунных тромбозах независимо от генеза происходит внутрисосудистая агрегация тромбоцитов.
В последние годы значительно изменился взгляд на патогенез иммунных тромбозов. Если предыдущие концепции сводились к ингибиции патофизиологически важных естественных антитромботических агентов (антигенов) антителами, то в настоящее время основную роль отводят связыванию антител через различные протеины с клетками крови (тромбоциты и др.) или мембраной эндотелиальных клеток с последующей активацией протромботических механизмов этими клетками через их FcgRII-рецепторы или через комплементарный каскад.
Наиболее изученными на сегодняшний день считаются механизмы возникновения гепарининдуцированной тромбоцитопении и тромбоза, обусловленного ГИТ.
Различают 2 типа ГИТ: наиболее частый I тип имеет раннее начало, сопровождается легкой тромбоцитопенией, возможно, связанной со способностью фракций гепарина (в основном нефракционированного), не обладающих антикоагулянтной активностью, усиливать небольшую активность тромбоцитов; тип II обусловливает спорадические, изолированные случаи тяжелой тромбоцитопении с поздним началом, иммуноспровоцированные и часто ассоциирующиеся с катастрофическим тромбозом.
В основе лечения тромбофилических состояний и ДВС-синдрома лежит устранение непосредственной причины их возникновения (например, антибиотикотерапия при гнойно-септических процессах), а также воздействие на основные звенья патогенеза. Целый ряд состояний в акушерстве диктует необходимость проведения профилактических мер.
Показания к профилактике тромбоэмболических осложнений во время беременности и в послеродовом периоде:
• беременные в возрасте старше 35–40 лет
• беременные с экстрагенитальной патологией, особенно с заболеваниями сердечно-сосудистой системы и почек
• повторнобеременные с отягощенным акушерским анамнезом (гнойно-септические заболевания, антенатальная гибель плода, задержка развития плода, нефропатия, преждевременная отслойка нормально расположенной плаценты)
• наличие в анамнезе тромбозов и тромбоэмболий
• беременные, которым показана операция при беременности
• осложненное течение беременности, родов и послеродового периода: (нефропатия, преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, гнойно-септические заболевания, массивные гемотрансфузии)
• острые тромбозы и тромбоэмболии
• генетические формы тромбофилии.
Критериями противотромботической терапии в акушерской практике являются ее эффективность и безопасность для матери и плода. Из всего арсенала противотромботических средств (непрямые и прямые антикоагулянты, антиагреганты, тромболитики) препаратами выбора были и остаются гепарин натрий и его производные. В акушерской практике гепарин натрий занимает особое место в связи с немедленным антикоагулянтным эффектом, существованием антидота, легкостью управления дозой, отсутствием тератогенного и эмбриотоксического эффектов. Непрямые антикоагулянты проходят через плаценту и обладают тератогенным и эмбриотоксическим эффектами. В исключительных случаях их применение ограничено II триместром беременности, когда органогенез завершен.
Однако, несмотря на множество преимуществ, обычный нефракционированный или высокомолекулярный гепарин обладает рядом нежелательных побочных свойств, которые в основном предопределены его структурой. Нефракционированный гепарин (НГ) представляет собой смесь кислых макромолекулярных цепей сульфатированных анионов мукополисахаридов с высоковариабельной молекулярной массой от 4000 до 40 000 Д.
Вследствие гетерогенности структуры НГ имеет биодоступность лишь 30%, так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. Это чревато возникновением гепариновой иммунной тромбоцитопении в результате образования антител к этому комплексу (наиболее опасная форма тромбоза).
Одним из нежелательных эффектов гепарина натрия является истощение АТ III при длительном его применении в больших дозах, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина натрия в такой ситуации не приводит к антикоагулянтному эффекту.
Последние 5-7 лет в клиническую медицину активно внедряются низкомолекулярные гепарины (НМГ), зарекомендовавшие себя с лучшей стороны, так как в большинстве случаев проявляют большую противотромботическую активность и достоверно гораздо более низкую выраженность геморрагических осложнений и других побочных эффектов.
НМГ получают путем деполимеризации НГ, их молекулярная масса колеблется в пределах от 4 до 8 кД. Деполимеризацию можно осуществить химическим, ферментным и физическим методом (g-излучение).
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность, чем НГ (около 98%), больший период полужизни. НМГ меньше связываются с различными белками, клетками. В отличие от НГ их почечный клиренс значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). Кроме того, НМГ в гораздо меньшей степени, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию в плазме (в 2-4 раза дольше).
НМГ не обладают антитромбиновым свойством и, следовательно, не вызывают гипокоагуляции. Противотромботический эффект НМГ в основном зависит от его влияния на фактор Ха.
Однако если в состав НМГ входят фракции с молекулярной массой более 5400 Д, что эквивалентно более чем 18 дисахаридным остаткам, то также проявляется анти-IIa-активность. Так, у одного из наиболее ранних НМГ, надропарина кальция, молекулярная масса которого в среднем 4500 Д, благодаря фракциям с молекулярной массой больше 5400 Д соотношение анти-IIa- и анти-Ха-активности равно 1:4.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-PA; кроме того, они меньше подвержены действию антигепаринового фактора IV тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Прогресс в области гемостазиологии показал, что в генезе большинства тромботических явлений огромную роль играют активация внешнего пути свертывания и выделение в кровь тканевого фактора (ТФ). Этот механизм преобладает во время беременности, в перинатальном, послеоперационном периодах, при гнойно-септических заболеваниях, антифосфолипидном синдроме (АФС), ожирении, онкологических и множестве сердечно-сосудистых заболеваний, а также при ряде связанных с ними состояний: пороках сердца, кава-фильтре, чрескожной транслюминальной коронарной ангиопластике, тромбоэмболии легочной артерии, дистресс-синдроме легких, отслойке плаценты, эмболии околоплодными водами и др.
TFPI-фактор, или липопротеин-ассоциированный ингибитор коагуляции (LACI-фактор), является мощным естественным ингибитором внешнего пути свертывания. НМГ способны значительно повышать его уровень в крови. TFPI-фактор контролирует обусловленный фактором Ха механизм отрицательной обратной связи и ингибирует ряд комплексов, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина.
TFPI имеет и другие фармакологические свойства, как потенциальное антитромботическое средство: это ингибитор образования протеаз, прямой ингибитор фактора Ха и эластазы, ингибитор, обусловленный ТФ активации тромбоцитов и макрофагов; он взаимодействует с липопротеинами низкой плотности с изменением их патогенетической роли (особенно при атеросклерозе), взаимодействует с эндотелием сосудов, обеспечивает модуляцию эндогенных гликозаминогликанов, нейтрализует эндогенно образующийся ТФ.
В нормальных физиологических условиях TFPI синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов. Незначительные количества TFPI исходят из фибробластов, но при активации этих клеток уровнь TFPI повышается в 6-8 раз.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина. Если учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о применении НМГ у больных с дефицитом АТ III.
В отличие от НГ, благодаря меньшей молекулярной массе и большей биодоступности, НМГ дольше циркулируют в крови и обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Возможно однократное подкожное введение препарата в сутки: препараты не вызывают образования гематом в области инъекций.
НМГ не вызывают гипокоагуляции, поскольку противотромботический эффект направлен на ингибцию Ха-фактора и внешнего пути свертывания крови; в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не обусловливают иммунных тромбозов (табл. 1).
Учитывая механизм действия НМГ и результаты их применения в широкой клинической практике, большинство исследователей считают, что нет необходимости в лабораторном контроле при использовании НМГ в профилактических целях. Тем не менее оценку их антикоагулянтного эффекта можно проводить по анти-Ха-активности. Биологические методы контроля терапии НГ и НМГ с учетом их действия на различные компоненты системы гемостаза представлены в таблице 2.
До появления НМГ контроль терапии преследовал цель обеспечения адекватной дозы НГ во избежание опасных геморрагических осложнений. При применении НМГ практически не существует проблемы гипокоагуляционных эффектов. Однако, весьма актуален контроль эффективности препарата. Для этой цели можно использовать такие маркеры тромбофилии, как комплекс тромбин-антитробмин, фрагмены F1+2 протромбина и особенно продукты деградации фибрина-фибриногена. Маркеры внутрисосудистого свертывания крови и тромбофилии представлены в таблице 3.
Установление отсутствия трансплацентарного перехода НМГ открыло большие возможности широкого применения его в акушерской практике, особенно у беременных с заболеваниями сердечно-сосудистой системы, с АФС и при ряде состояний, сопровождающихся тромбофилией и внутрисосудистым свертыванием крови. Преимущественное воздействие НМГ на внешний путь свертывания крови открывает заманчивую перспективу лечения эндотелиальных изменений при гестозах.
Положительным свойством НМГ (в частности, надропарина кальция) является купирование в течение 2-3 дней ДВС-синдрома у беременных с гестозами. Как правило, это сопровождается и регрессом заболевания. Однако если основные проявления гестоза не исчезают, то терапия НМГ более 1 нед нецелесообразна. Возможно, наблюдаемый положительный эффект НМГ у беременных с начальными формами гестоза обусловлен воздействием на эндотелий. Помимо стабилизирующего влияния антиагрегантов и антикоагулянтов, НМГ препятствуют экспрессии фактора Виллебранда на эндотелии.
Раствор Фраксипарина выпускается в одноразовых шприцах по 0,3, 0,4, 0,6, 1 мл. Это удобно в применении, инъекции безболезненны и не оставляют гематом. Препарат вводят под кожу брюшной стенки, что делает возможным его применение в амбулаторных условиях.
Таким образом, применение НМГ в акушерской практике открывает новые перспективы для эффективной профилактики и лечения тромбоэмболических осложнений, заболеваний, протекающих с ДВС-синдромом, а также шока и шокоподобных состояний.
Сравнительная оценка эффективности и безопасности низкомолекулярных гепаринов
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
С 1990-х гг. до настоящего времени в США и других странах Америки и Европы, а также в России отмечено увеличение оперативной активности в ортопедии и травматологии [3]. Внедрение современных хирургических технологий привело к значительному росту числа операций эндопротезирования суставов и погружного остеосинтеза. Эти вмешательства проводятся преимущественно у пациентов пожилого и старческого возраста на фоне имеющихся у большинства из них сопутствующих заболеваний, сопровождаются повышенной опасностью развития венозных тромбоэмболических осложнений (ВТЭО) – тромбоза глубоких вен (ТГВ) голени, бедра, илеокавального сегмента и тромбоэмболии легочной артерии (ТЭЛА). У пациентов с проведенными операциями по полной замене тазобедренного сустава (ПЗТС) частота развития ТГВ несмотря на лечение антикоагулянтами в течение 5–11 дней достигает 20% [3, 13]. С помощью адекватных профилактических мероприятий можно добиться снижения частоты послеоперационных тромботических осложнений в 3–4 раза [2, 4, 5, 7]. При этом в 8 раз уменьшается число послеоперационной летальности, связанной с ТЭЛА [1, 15].
Междисциплинарный экспертный совет по разработке рекомендаций (протокола) «Ведение беременных женщин с риском тромбозов и осложнений беременности на ф
Приведены рекомендации по ведению беременных с риском тромбоза и осложнений беременности, обусловленных активацией системы гемостаза, подходы к профилактике и лечению тромбозов у беременных, профилактики акушерских осложнений, методы профилактики тромбоэм
The paper includes recommendations on guiding the pregnant with the risk of thrombosis and pregnancy complications conditioned by activation of hemostasis system, approaches to prevention and treatment of thrombosis in the pregnant, prevention of obstetric complications, methods of prevention of post-partum thromboembolic complications.
Междисциплинарный экспертный совет, состоявшийся в Санкт-Петербурге 17 июня 2017, был посвящен разработке рекомендаций по ведению беременных женщин с риском тромбозов и осложнений беременности на фоне активации системы гемостаза.
В структуре осложнений беременности существенная роль принадлежит осложнениям, связанным с нарушениями в системе гемостаза, которые можно разделить на две группы: венозные тромбоэмболические осложнения (ВТЭО) и собственно акушерские осложнения (преэклампсия, синдром потери плода, задержка роста плода, отслойка плаценты и др.). В основе патогенеза последних лежит нарушение фетоплацентарного кровообращения с тромбозами в зоне микроциркуляции плаценты.
Фармакологическая профилактика тромбоэмболических осложнений во время беременности
В настоящее время низкомолекулярные гепарины (НМГ) являются единственной безопасной группой антикоагулянтов для профилактики и лечения тромбозов у беременных. В отсутствие больших рандомизированных или сравнительных исследований, которые у беременных проводить очень сложно, препараты этой группы в соответствии с инструкциями производителей могут использоваться в случаях, когда ожидаемая польза превышает риск предполагаемых осложнений. Решение о назначении препаратов (при отсутствии необходимости коллегиального заключения мультидисциплинарной команды) принимает акушер-гинеколог.
Международными и Российскими рекомендациями четко определены факторы риска ВТЭО и показания к назначению профилактического введения НМГ (далее — тромбопрофилактики), а также тактика лечения развившихся осложнений. В соответствии с этими рекомендациями решение о назначении тромбопрофилактики с применением НМГ во время беременности или после родов принимается индивидуально согласно стратификации пациентки по факторам риска, представленным в табл. 1, рис.
Женщинам с анамнезом ВТЭО (за исключением женщин с однократным ВТЭО, связанным с обширным оперативным вмешательством, при отсутствии других факторов риска) следует проводить тромбопрофилактику с помощью НМГ в течение всего антенатального периода.
Всем женщинам, имеющим четыре или более действующих фактора риска (кроме перенесенных ранее ВТЭО и/или наличия тромбофилии), следует назначать НМГ в профилактических дозах в течение всей беременности до родов и 6 недель послеродового периода.
Всем женщинам, имеющим три действующих фактора риска (кроме перенесенных ранее ВТЭО и/или наличия наследственной тромбофилии и АФС), рекомендовано профилактическое применение НМГ с 28-й недели беременности до родов и в течение 6 недель после родов (при обязательной послеродовой оценке риска ВТЭО).
Всем женщинам, имеющим два действующих фактора риска (кроме перенесенных ранее ВТЭО и/или наличия наследственной тромбофилии и АФС), рекомендовано профилактическое применение НМГ в течение не менее 10 дней послеродового периода.
Женщинам, госпитализированным во время беременности в гинекологические отделения с неукротимой рвотой беременных, синдромом гиперстимуляции яичников (СГЯ) или с вынужденной иммобилизацией, рекомендовано проведение тромбопрофилактики НМГ при отсутствии абсолютных противопоказаний (активное кровотечение).
Женщинам с анамнезом ВТЭО, ассоциированных с АФС, рекомендовано проводить тромбопрофилактику более высокими дозами НМГ (50%, 75% или полная терапевтическая доза) во время беременности и в течение 6 недель после родов или до перевода на терапию пероральными антикоагулянтами, если это требуется. Беременных женщин с АФС следует лечить совместно с гематологом и/или ревматологом, имеющим опыт работы в данной области.
Гетерозиготные мутации генов FV (Лейден), FII (G20210A) или антифосфолипидные антитела рассматриваются в качестве слабых факторов риска тромбоза у женщин без каких-либо клинических проявлений ВТЭО (табл. 1). При наличии трех дополнительных факторов риска у таких пациенток нужно рассмотреть возможность проведения антенатальной тромбопрофилактики НМГ с продолжением в течение как минимум 10 дней после родов; при наличии двух дополнительных факторов риска следует рассмотреть возможность проведения тромбопрофилактики с 28-й недели НМГ с продолжением в течение как минимум 10 дней после родов; при наличии одного дополнительного фактора риска или бессимптомной тромбофилии рекомендована тромбопрофилактика НМГ в течение 10 дней послеродового периода.
Женщины с бессимптомным дефицитом антитромбина, протеина С или протеина S или имеющие более одного тромбофилического дефекта (включая гомозиготную мутацию фактора V Лейдена, гена протромбина или комбинацию гетерозиготного носительства этих мутаций) должны быть направлены к эксперту (гематологу, акушеру с опытом ведения беременных с патологией гемостаза) для решения вопроса об антенатальной тромбопрофилактике. Данной категории пациенток также рекомендована тромбопрофилактика в течение 6 недель после родов даже в отсутствие дополнительных факторов риска.
Антенатальную тромбопрофилактику у пациенток с ранее перенесенными ВТЭО при наличии соответствующих показаний следует начинать во время беременности как можно раньше.
Сроки тромбопрофилактики при наличии преходящих факторов риска определяются клиническим состоянием:
Фармакологическая профилактика тромбоэмболических осложнений после родов
У женщин с двумя или более устойчивыми факторами риска, перечисленными в табл. 1, следует рассмотреть вопрос о применении НМГ в течение 10 дней после родов в профилактических дозах, соответствующих их массе тела.
Всем женщинам после проведения экстренного кесарева сечения следует назначать тромбопрофилактику с помощью НМГ в течение 10 дней после родов. У женщин с плановым кесаревым сечением следует рассмотреть вопрос о проведении тромбопрофилактики с помощью НМГ в течение 10 дней после родов при наличии дополнительных факторов риска (табл. 1).
У всех женщин с ожирением III степени (ИМТ 40 кг/м 2 и больше) следует рассмотреть вопрос о профилактическом применении НМГ в течение 10 дней после родов в дозах, соответствующих их массе тела.
Первую тромбопрофилактическую дозу НМГ при наличии соответствующих показаний необходимо ввести после родов в течение первых суток, но не ранее чем через 6 часов после самопроизвольных родов и не ранее чем через 8–12 часов после кесарева сечения при условии надежного гемостаза.
У женщин с тромбозом в анамнезе, с тромбофилией и/или семейной историей ВТЭО тромбопрофилактику необходимо продолжать в течение 6 недель; у женщин после операции кесарева сечения, с ожирением или при сопутствующей соматической патологии, а также при увеличении сроков пребывания в стационаре более 3-х дней тромбопрофилактику необходимо продолжать в течение 10 дней.
У женщин с дополнительными стойкими (продолжительностью более 10 дней после родов) факторами риска, такими как длительная госпитализация, раневая инфекция или оперативное вмешательство в послеродовом периоде, тромбопрофилактику следует продлить до 6 недель или до исчезновения дополнительных факторов риска.
Регионарные методы обезболивания не следует применять, если это возможно, по крайней мере в течение 12 часов после введения профилактической дозы НМГ и в течение 24 часов после введения терапевтической дозы НМГ.
НМГ не следует назначать в течение 4 часов после проведения спинальной анестезии или после удаления эпидурального катетера. Эпидуральный катетер не следует удалять в течение 12 часов после последней инъекции НМГ.
Показания к обследованию на тромбофилию с точки зрения профилактики ВТЭО
В настоящее время показания к обследованию на тромбофилию существенно ограничены; оно должно проводиться только в том случае, если результаты повлияют на тактику ведения пациентки. Обследование должно проводиться до наступления беременности, так как беременность может повлиять на результат исследований.
Женщина, несколько родственников которой имели тромбозы, должна рассматриваться как носитель дефицита антитромбина, и его выявление может повлиять на решение о профилактике.
Женщины с неспровоцированным ВТЭО должны быть обследованы на антифосфолипидные антитела (волчаночный антикоагулянт, антитела к кардиолипину IgG/IgM и β2-гликопротеину IgG/IgM) для исключения АФС.
Наличие в анамнезе непровоцированного тромбоза или тромбоза, ассоциированного с приемом эстрогенов или беременностью, является показанием к профилактике. В этом случае дополнительной пользы от тестирования на тромбофилию получено не будет.
На тактику профилактики ВТЭО может повлиять выявление при беременности определенных видов тромбофилии: при обнаружении дефицита антитромбина или АФС изменяется доза препаратов, используемых для тромбопрофилактики, что определяет целесообразность данного обследования.
Профилактика акушерских осложнений, связанных с патологией системы гемостаза (тромбофилическим риском)
Учитывая, что физиологическая гиперкоагуляция беременности способствует патологическому тромбообразованию (клиническим проявлениям склонности к тромбозам), в том числе с нарушениями микроциркуляции в фетоплацентарном комплексе, оценка риска не только тромботических, но и акушерских осложнений необходима каждой женщине на этапе планирования и во время беременности.
Критерии оценки рисков и тактика профилактики акушерских осложнений, связанных с активацией системы гемостаза, на сегодняшний день окончательно не определены. В профессиональных сообществах акушеров-гинекологов, гематологов-гемостазиологов, анестезиологов-реаниматологов, специалистов по вспомогательным репродуктивным технологиям продолжаются дискуссии и высказываются мнения от полного неприятия профилактического назначения НМГ до огульного их использования практически у всех беременных.
Основываясь на большом опыте различных школ Санкт-Петербурга (акушеров-гинекологов, гематологов, специалистов по лабораторной диагностике, патофизиологов), принимая во внимание необходимость выработки единых подходов и стратегии для обеспечения преемственности ведения женщин с осложнениями или высоким риском осложнений беременности, группа экспертов в результате активного обсуждения и рассмотрения различных точек зрения пришла к следующим заключениям.
Анамнестические данные, включающие акушерскую, соматическую и семейную историю женщины, являются ведущими в оценке риска акушерских осложнений, связанных с патологий гемостаза, и должны стратифицироваться неоднократно у каждой женщины одновременно и даже опережающим образом по сравнению со скрининговыми тестами коагулограммы, включая определение концентрации D-димеров.
К отягощенному личному акушерскому анамнезу относят:
1) синдром потери плода:
2) преэклампсия (гестоз тяжелой степени)/HELLP-синдром, преждевременная отслойка плаценты;
3) задержка развития плода;
4) три и более неудачи ВРТ (исключая искусственную инсеминацию в связи с мужским фактором бесплодия).
При оценке риска акушерских осложнений целесообразно также учитывать:
1) отягощенный семейный акушерский анамнез: привычное невынашивание, мертворождение или тяжелый гестоз у родственников);
2) отягощенный личный тромботический анамнез: тромбозы различной локализации, инсульты, транзиторные ишемические атаки, инфаркты;
3) отягощенный семейный тромботический анамнез: тромбозы различной локализации, инсульты, инфаркты у родственников первой линии в возрасте до 50 лет;
4) отягощенный личный соматический анамнез: заболевания легких и сердца, системные аутоиммунные заболевания (например, системная красная волчанка), онкологические заболевания, артериальная гипертензия, варикозная болезнь (сегментарный варикоз), ожирение (ИМТ > 30 кг/м 2 ), воспалительные заболевания кишечника, нефротический синдром, сахарный диабет 1-го типа, серповидно-клеточная анемия, курение, употребление внутривенных лекарственных средств;
5) возраст беременной старше 35 лет.
Стратификацию рисков осложнений беременности, связанных с патологией гемостаза, необходимо проводить по возможности до наступления беременности, в момент установления факта маточной беременности или постановки на учет и далее неоднократно в зависимости от течения беременности.
К акушерским факторам риска гестационных осложнений, возникших на фоне данной беременности, относят:
1) многоплодную беременность;
2) применение ВРТ (индукция овуляции, ЭКО);
3) СГЯ;
4) токсикоз первой половины беременности тяжелой степени.
Генетический анализ на тромбофилию, определение уровня гомоцистеина и антифосфолипидных антител являются основными лабораторными исследованиями в оценке риска потери беременности и формирования акушерских осложнений.
Наследственные тромбофилии, включающие дефицит антитромбина, протеина С, протеина S, мутацию гена фактора V свертывания крови (Лейденская мутация) и мутацию гена протромбина G20210A, являются несомненными факторами риска плацентарно-ассоциированных акушерских осложнений за счет микротромбообразования и нарушения фетоплацентарного кровообращения [4–9]. Полиморфизмы других компонентов системы гемостаза широко распространены в популяции, их клиническое значение в формировании тромбозов и акушерских осложнений не доказано.
Носительство антифосфолипидных антител может быть значимым для развития осложнений беременности. Основными критериальными антителами для постановки диагноза АФС в соответствии с международными рекомендациями являются волчаночный антикоагулянт, антикардиолипиновые антитела и антитела к β2-гликопротеину I (класс IgG и IgM) [1]. Тем не менее дополнительное исследование других антител (к аннексину V, протромбину, фосфатидилсерину, фосфатидилинозитолу, фосфатидиловой кислоте, двуспиральной ДНК, антинуклеарному фактору и т. д.) может быть полезно у женщин с анамнезом акушерских осложнений, но без четких клинических или лабораторных критериев классического АФС [2, 3]. Однако оценка их присутствия и клинические выводы, в том числе для назначения антикоагулянтной защиты, могут обсуждаться только в совокупности с анамнестическими данными и данными о течении настоящей беременности при участии мультидисциплинарной команды.
Результат комплексной оценки анамнестических, клинических и лабораторных данных может быть основанием для использования у беременных препаратов, снижающих тромботический потенциал в сосудисто-тромбоцитарном и плазменном звене.
НМГ являются препаратами выбора для профилактики плацентарно-опосредованных осложнений у беременных [10–16].
Пациенткам с известной наследственной тромбофилией и акушерскими факторами риска, возникшими на фоне данной беременности, необходимо рассмотреть вопрос о назначении НМГ в профилактических дозах в антенатальном периоде.
При сочетании отягощенного акушерского анамнеза, соматического анамнеза и/или возраста старше 35 лет рассмотреть вопрос о назначении антиагрегантов (низких доз ацетилсалициловой кислоты — 50–100 мг в сут) и/или профилактических доз НМГ. Решение принимается в составе мультидисциплинарной команды.
В случае подтвержденного АФС (табл. 2), без анамнеза тромбоза, рекомендованы низкие дозы аспирина (50–100 мг/сут) на этапе планирования с добавлением НМГ в профилактической дозе с момента подтверждения маточной беременности [17–22].
В случае наличия неполных клинико-лабораторных критериев АФС и осложненного акушерского анамнеза, независимо от наличия дополнительных факторов риска, рекомендованы низкие дозы ацетилсалициловой кислоты (50–100 мг/сут) на этапе планирования или профилактические дозы НМГ с момента подтверждения маточной беременности [2, 3, 20, 23–26]. Решение принимается в составе мультидисциплинарной команды.
Дополнительные лабораторные исследования, оценивающие степень гиперкоагуляционных нарушений, такие как тест генерации тромбина, тромбодинамика, тромбоэластография/метрия, должны оцениваться у беременных женщин с осторожностью. В настоящее время недостаточно данных для внедрения этих тестов в широкую клиническую практику или для принятия на основании их результатов клинических решений у конкретной пациентки.
Своевременная коррекция нарушений в системе гемостаза, проводимая с учетом всех клинических и лабораторных данных, позволяет существенно снизить риск осложнений для матери и плода [10–16].
Литература
Венозные тромбоэмболические осложнения — тромбоз глубоких вен (ТГВ), тромбоз поверхностных вен (ТПВ) и тромбоэмболия легочной артерии (ТЭЛА).
Тромбофилия — состояние, характеризующееся наклонностью к патологическому тромбообразованию в кровеносных сосудах разной локализации (преимущественно вен) вследствие нарушений состава и свойств крови.
Наследственная тромбофилия — дефицит естественных антикоагулянтов — антитромбина, протеина С, протеина S, мутация гена фактора V свертывания крови (Лейденская мутация) и мутация гена протромбина G20210A. Оценка состояния системы антикоагулянтов проводится по их функциональной активности в рамках исследования коагулограммы; результат представляется в %. Мутации генов факторов свертывания V и II выявляются с помощью полимеразной цепной реакции (ПЦР-диагностика). Гомозиготное носительство патологического аллеля встречается крайне редко и относится к строгим факторам риска тромбоза (увеличение риска от 7 до 80 раз). Гетерозиготное носительство относится к слабым факторам риска (в 3,5–6 раз). Ни одна из наследственных тромбофилий не влияет на возникновение рецидивов, за исключением дефицита антитромбина, и то в слабой степени (увеличение риска в 2,6 раза) (2016).
Антифосфолипидный синдром (АФС) — приобретенная форма тромбофилии, представляющая собой аутоиммунное мультисистемное расстройство с окклюзионным поражением сосудов (артерий и вен) в результате образования антител к белково?фосфолипидным комплексам цитоплазматических мембран. Диагноз АФС выставляется в соответствии с международными критериями, принятыми в Сиднее в 2005 г.: наличие клинических признаков (венозные или артериальные тромбозы и потери плода, классифицированные в соответствии со сроком беременности) и лабораторных признаков (персистирующий волчаночный антикоагулянт и/или персистирующие антитела к кардиолипину IgG/IgM и/или β2?гликопротеину IgG/IgM в умеренном/высоком титре) (табл. 2). Другие формы антифосфолипидных антител (антитела к аннексину V, протромбину, фосфотидилсерину и др.) не являются основанием для постановки диагноза антифосфолипидного синдрома, но рассматриваются в качестве фактора риска осложнений беременности.
Гипергомоцистеинемия — смешанная (наследственная и приобретенная) форма тромбофилии, характеризующаяся повышением уровня гомоцистеина в крови, превышающим 15 мкмоль/л, и слабо ассоциированная с венозными и артериальными тромбозами. Промежуточная и высокая концентрации гомоцистеина (31–100 мкмоль/л и > 100 мкмоль/л) являются более строгими факторами риска, особенно в сочетании с курением.
* ФГБУВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
** ФГБУ РосНИИГТ ФМБА России, Санкт-Петербург
*** ФГБУ СЗФМИЦ им. В. А. Алмазова МЗ РФ, Санкт-Петербург
**** СПб ГБУЗ Родильный дом № 6 им. проф. В. Ф. Снегирева, Санкт-Петербург
***** ФГБНУ НИИ АГиР им. Д. О. Отта, Санкт-Петербург
Междисциплинарный экспертный совет по разработке рекомендаций (протокола) «Ведение беременных женщин с риском тромбозов и осложнений беременности на фоне активации системы гемостаза»/ М. А. Репина, Л. П. Папаян, Т. В. Вавилова, И. Е. Зазерская, М. С. Зайнулина, Т. М. Корзо, С. А. Бобров, Е. А. Корнюшина.
Для цитирования: Лечащий врач №11/2017; Номера страниц в выпуске: 57-64
Теги: беременные, тромбофилия, антифосфолипидный синдром, гипергомоцистеинемия



_575.gif)
_575.gif)
_575.gif)
.gif)