Нмг профилактика что это
Профилактика венозных тромбоэмболических осложнений при хирургическом лечении пациенток с гинекологическими заболеваниями
Статья посвящена существующим на настоящий момент мерам профилактики тромбоэмболических осложнений и их эффективности при хирургических вмешательствах, в том числе и в гинекологии в соответствии со стратегией риска. Наибольшие успехи достигнуты при исполь
Венозные тромбоэмболические осложнения (ВТЭО) — собирательное понятие, объединяющее собой тромбоз подкожных и глубоких вен, а также тромбоэмболию легочной артерии (ТЭЛА). В клинической практике врача любой специальности, особенно хирургической, крайне важное значение имеют, в первую очередь, тромбоз глубоких вен (ТГВ) и ТЭЛА, возможности их своевременной диагностики и лечения и, конечно, мер профилактики. Венозный тромбоэмболизм представляет собой одну из наиболее серьезных и, к сожалению, не до конца решенных проблем современной медицины. ВТЭО оказывают значительный социальный и экономический ущерб, характеризуясь высокими показателями как распространенности, так и летальности по всему миру. Ежегодно в мире диагностируется более 900 тыс. эпизодов ТГВ и ТЭЛА, которые становятся причиной около 300 тыс. смертей [1]. После инфаркта миокарда и инсульта тромбоэмболические осложнения являются третьей ведущей причиной смерти среди сердечно-сосудистых заболеваний. Так, по данным E. Oger (2000), J. A. Heit и соавт. (2001), R. H. White и соавт. (2005), ежегодная частота возникновения ТГВ составляет 90–220 случаев на 100 тыс. населения. Точные статистические данные по заболеваемости и смертности от ТЭЛА на сегодняшний день не известны, во многом из-за высокой частоты нефатальных и асимптомных форм. Однако по данным 25-летнего популяционного исследования M. D. Silverstein и соавт. (1998), проведенного в штате Миннесота (США), примерная распространенность ТЭЛА оценивается как 1 случай на тысячу человек населения в год. Другие исследования определяют этот показатель от 0,5 до 2,08 на тысячу населения в год. В США от легочной эмболии как непосредственной причины смерти погибают около 200 тыс. человек в год. Отмечено, что риск ТЭЛА резко возрастает у лиц, находящихся на стационарном лечении, причем независимо от диагноза. P. D. Stein (2004) показал, что среди госпитализированных пациентов распространенность ТЭЛА в США составляет уже 0,4%, по некоторым данным — достигает 12–15% по результатам аутопсии пациентов, умерших в больнице, у онкологических пациентов — на каждой второй аутопсии обнаруживаются признаки тромботических осложнений (Kakkaretal, 1999). Смертность при ТЭЛА достигает 30%, однако адекватная тактика ведения пациента с точной диагностикой и своевременно начатым лечением позволяет снизить этот показатель до 2–8%. В то же время ВТЭО являются потенциально предотвратимыми, подчеркивая значимость профилактических мероприятий.
На сегодняшний день установлено, что ВТЭО является многофакторным заболеванием со сложными механизмами развития. Среди факторов риска — артериальная гипертензия, сахарный диабет, курение, возраст, беременность и роды, злокачественные новообразования, антифосфолипидный синдром, наследственные тромбофилии и др. Для профилактики тромбоэмболических осложнений в настоящее время разработан алгоритм, который включает определение степени риска с учетом общего состояния пациента, его индивидуальных особенностей и соматического здоровья, анамнеза и наследственности, а также оценку объема предстоящей манипуляции или операции и проведение профилактических мероприятий, соответствующих степени риска. Оценку хирургического вмешательства, его длительность и объем необходимо обязательно проводить, так как операция сама по себе значительно повышает риск тромботических осложнений. Более 30% случаев тромбоэмболии легочной артерии и тромбозов глубоких вен непосредственно связаны с общехирургическими вмешательствами, при ортопедических операциях их частота составляет уже около 50% [5]. В 1960-х гг. В. Каккар, используя йод-125-меченный фибриноген, продемонстрировал естественную картину развития тромботических осложнений у 132 больных после оперативного вмешательства. Автором было показано, что тромбы (подтвержденные также флебографически) сформировались в первые 1–3 дня после операции у 40 больных (30%). У 14 из них тромб спонтанно лизировался в течение последующих 72 часов, а у 26 пациентов лизиса не было отмечено. В последней группе из 26 пациентов у 4 развилась ТЭЛА. В настоящее время механизмы тромбообразования изучены более детально. Обширные оперативные вмешательства, как и любой другой род травмы, включают механизм системной воспалительной реакции, заключающийся в выработке и выделении в кровь большого количества биологически активных веществ. Каскад цитокинов активирует лейкоциты и способствует их адгезии к эндотелию сосудов. Выделяемые активированными лейкоцитами мощные оксиданты вызывают гибель эндотелиальных клеток с последующим обнажением субэндотелиального слоя. Кроме того, тромбообразованию способствует выброс тканевого тромбопластина в кровоток непосредственно при иссечении тканей, который существенно активируют систему свертывания, и длительная иммобилизация больных в послеоперационном периоде, способствующая стазу крови в венозном русле [2, 3]. В исследовании White и соавт. (2003), охватившем более 1,6 млн хирургических процедур, было установлено, что важнейшими предикторами развития ВТЭО в первые 3 мес после операции являются возраст (относительный риск (ОР) — 1,1 на каждые 5 лет), венозная тромбоэмболия (ВТЭ) в анамнезе (ОР 6,2) и наличие злокачественного новообразования (ОР 1,7). Хирургическое лечение, применяемое у больных со злокачественными новообразованиями, — дополнительный фактор риска развития тромбоэмболических осложнений, поскольку у таких пациентов система свертывания крови уже оказывается предактивированной ко времени операции. Связь ВТЭО с раком подтверждена документально. Еще в 1865 г. в лекции Арман Труссо описал 3 случая сочетания тромбофлебита и рака. Риск тромбоза среди пациентов с онкологическими заболеваниями приблизительно в 4 раза выше, чем в популяции, и этот риск возрастает в 6–7 раз при проведении как консервативного (химио-, гормоно- и лучевой терапии), так и оперативного лечения. Что же определяет наклонность онкологических больных к тромбозам? В целом ряде случаев это сочетание причин. Многие опухолевые клетки продуцируют тканевой тромбопластин и опухолевый прокоагулянт (цистеиновой транспептидазы). Борьба организма с опухолью сопровождается ростом содержания в крови провоспалительных цитокинов (фактора некроза опухоли альфа, интерлейкинов, интерферона гамма), способных повреждать клетки эндотелия, снижая его противотромботические свойства. Прогрессии тромбоза способствует цитостатическая и гормональная терапия, повреждающая как эндотелий, так и опухолевые клетки с выходом прокоагулянтных субстанций в кровоток [9]. Кроме того, сам по себе рост опухоли может создавать условия для тромбообразования за счет замедления кровотока при сдавлении сосудов и их инфильтрации. Оперативные вмешательства в значительной мере увеличивают риск тромбоза. Исследования, проведенные в ГУ РОНЦ им. Н. Н. Блохина РАМН, показали, что под влиянием оперативного вмешательства уже в начале операции отмечается активизация системы гемостаза, которая нарастает в наиболее травматичный момент и к концу операции. Усиливается общая свертывающая способность крови, повышается содержание маркеров внутрисосудистого свертывания крови и тромбообразования, агрегационная активность тромбоцитов. В послеоперационном периоде гиперкоагуляция нарастает, развивается гиперкомпенсированная форма хронического внутрисосудистого свертывания крови. Указанные изменения способствуют тромбообразованию в глубоких венах нижних конечностей и микроциркуляторном русле жизненно важных органов [1, 4]. Таким образом, оперативные вмешательства на органах малого таза у пациенток с гинекологическими и онкогинекологическими заболеваниями сопряжены с повышенным риском возникновения тромбоэмболических осложнений и требуют обязательного применения мер тромбопрофилактики.
В настоящее время оптимальным следует признать подход, согласно которому профилактику ВТЭО проводят всем больным хирургического профиля, но характер применяемых профилактических мер определяется стратегией риска. Отнесение пациентки к группе с низким, умеренным или высоким риском осуществляется на основании существующих балльных шкал, учитывающих планируемый объем и продолжительность оперативного лечения, соматический статус, анамнез пациентки и другие факторы риска возникновения тромбоэмболических осложнений [2, 7]. В существующих на данный момент протоколах по профилактике тромботических осложнений во всех случаях рекомендуется наиболее ранее прекращение постельного режима и активизация больных после оперативного лечения. Однако у больных с повышенным риском венозного тромбоза (> 0,5%, по шкале Rogers > 7, по шкале Caprini > 0) подобный подход не должен быть единственным способом профилактики, так как не обеспечивает достаточной защиты. У пациенток с низким риском ВТЭО (1,5%, по шкале Rogers 7–10, по шкале Caprini 1–2) рекомендуется использование механических методов профилактики интраоперационно и в послеоперационном периоде. Механические методы включают в себя использование специального противоэмболического компрессионного трикотажа у пациентов с длительным постельным режимом и обычного лечебного и профилактического трикотажа у мобильных больных, обеспечивающие адекватный венозный отток. Эластические бинты могут быть использованы только в случае, когда бандаж создан врачом или обученной медицинской сестрой, владеющими правильной техникой бинтования. В любом другом случае использование эластических бинтов не может считаться методом профилактики ВТЭО и недопустимо в клинической практике. Среди существующих методов механической тромбопрофилактики во всем мире эксперты отдают предпочтение переменной пневматической компрессии, с использованием манжет, воздействующих как только на стопу, так одновременно на стопу и голень. У пациенток с умеренным риском ВТЭО (3,0%, по шкале Rogers > 10, по шкале Caprini 3–4) рекомендуется использование фармакологических методов профилактики (низкомолекулярные гепарины — уровень доказательности 1В) либо механической профилактики (уровень 2С), вместо отсутствия профилактики [6]. У пациенток с высоким риском ВТЭО необходимо использовать фармакологическую профилактику, которую рекомендуется одновременно дополнить механическими методами компрессии. К фармакологическим средствам профилактики тромбозов относятся лекарственные препараты из группы антиагрегантов и антикоагулянтов. Профилактическая эффективность антиагрегантов (ацетилсалициловая кислота) не имеет достаточной доказательной базы, а по имеющимся данным не превышает таковую по сравнению с антикоагулянтами, поэтому их применение не рекомендуется в качестве единственного способа профилактики. В отношении антикоагулянтной терапии доказано, что она позволяет существенно сократить частоту фатальных случаев ТЭЛА, а также снизить риск рецидивов ВТЭО и поздних осложнений. Наибольшие успехи достигнуты при использовании препаратов из класса низкомолекулярных гепаринов (НМГ). По данным многочисленных исследований эти препараты зарекомендовали себя как эффективные и безопасные лекарственные средства по сравнению с другими антикоагулянтными препаратами для профилактики ВТЭО у пациентов не только хирургического, но и терапевтического профиля. НМГ обладают рядом потенциальных преимуществ перед нефракционированным гепарином (НФГ), включая высокую анти-Xa активность, прогнозируемый антикоагулянтный эффект, более длительный период полувыведения, лучшую биодоступность и меньшую частоту развития кровотечений. В рандомизированном многоцентровом исследовании с участием 184 пациентов хирургического профиля низкого и среднего риска развития ВТЭО сравнили эффективность НМГ (бемипарина) со стандартным НФГ. Бемипарин вводился подкожно по 2500 МЕ каждые 24 ч, начиная с первой дозы за 2 ч до начала операции. НФГ назначался в дозе 5000 МЕ подкожно каждые 12 ч. Продолжительность антикоагулянтной терапии составляла в обеих группах 7 дней. В итоге ни в одной группе ТГВ и ТЭЛА отмечено не было, однако были выявлены преимущества бемипарина в плане безопасности использования: уменьшение частоты случаев кровотечений, требующих переливания крови (0 против 9%, p
А. О. Духин, доктор медицинских наук, профессор
В. А. Любешкина 1
ФГБОУ ВПО РУДН, Москва
Abstract. The paper devoted to currently existing measures of prevention of thromboembolic complications and effectiveness in line with the strategy of risk. The greatest success achieved by the use of low-molecular-weight heparins.
Применение низкомолекулярных гепаринов в акушерской практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
Д о настоящего времени тромбозы и тромбоэмболические осложнения остаются основной причиной смерти в большинстве развитых стран. Только в США от артериальных и венозных тромбозов ежегодно погибает около 2 млн человек и приблизительно такому же числу больных ежегодно удается пережить эпизоды глубоких венозных тромбозов, тромбоэмболий, цереброваскулярных тромбозов, транзиторных ишемических атак, коронарных тромбозов, тромбозов сетчатки и т.д. Даже от злокачественных новообразований погибает приблизительно в четыре раза меньше больных. Это свидетельствует о том, что тромбозы являются экстраординарной причиной заболеваемости и смертности населения, в том числе и материнской. По обобщенным данным мировой литературы, на 1000 родов приходится 2-5 тромботических осложнений. 50% всех венозных тробмоэмболических осложнений возникают у женщин в возрасте до 40 лет и, как правило, они связаны с беременностью.
| На 1000 родов приходится 2-5 случаев тромботических осложнений. |
Таким образом, тенденция к стазу крови в сочетании с гиперкоагуляцией создает условия, благоприятствующие повышенному риску тромбообразования.
Дополнительными факторами риска по тромботическим осложнениям могут служить возраст (старше 35 лет), сердечно-сосудистая патология, эндокринные нарушения, гестоз, заболевания почек, гнойно-септические заболевания, а также ряд острых состояний (отслойка плаценты, эмболия околоплодными водами, длительная задержка мертвого плода в матке и др.). Гиперкоагуляция сменяется внутрисосудистым свертыванием крови, проявляющимся различными формами синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Следует отметить, что расширение показаний к кесареву сечению также сопряжено с повышенным риском тромбоза вследствие хирургического вмешательства, значительного изменения метаболизма, травмы, попадания тромбопластических субстанций в кровоток, иммобилизации, замедления венозного кровотока и пр.
Особое место среди факторов риска по тромбоэмболическим осложнениям занимают гнойно-септические процессы в области малого таза, так как в патологический процесс вовлекаются подвздошные, яичниковые, маточные вены, что может осложниться бактериальной легочной эмболией. При этом повышенная концентрация высокодисперсных белков плазмы (в частности, фибриногена) дополнительно опосредует повышенную структурную гиперкоагуляцию.
За последнее десятилетие клиническая картина обогатилась возможностями выяснения ряда ранее не известных патогенетических форм тромбоза: иммунных, а также генетических или так называемых наследственных дефектов гемостаза, предрасполагающих к тромбозу.
К иммунным формам относят тромбоз, обусловленный гепарин-индуцированной тромбоцитопенией (ГИТ), тромбоз, связанный с циркуляцией антифосфолипидных антител при антифосфолипидном синдроме, а также сравнительно недавно открытую новую форму иммунного тромбоза, обусловленного аутоантителами к фактору Виллебранда. При всех иммунных тромбозах независимо от генеза происходит внутрисосудистая агрегация тромбоцитов.
В последние годы значительно изменился взгляд на патогенез иммунных тромбозов. Если предыдущие концепции сводились к ингибиции патофизиологически важных естественных антитромботических агентов (антигенов) антителами, то в настоящее время основную роль отводят связыванию антител через различные протеины с клетками крови (тромбоциты и др.) или мембраной эндотелиальных клеток с последующей активацией протромботических механизмов этими клетками через их FcgRII-рецепторы или через комплементарный каскад.
Наиболее изученными на сегодняшний день считаются механизмы возникновения гепарининдуцированной тромбоцитопении и тромбоза, обусловленного ГИТ.
Различают 2 типа ГИТ: наиболее частый I тип имеет раннее начало, сопровождается легкой тромбоцитопенией, возможно, связанной со способностью фракций гепарина (в основном нефракционированного), не обладающих антикоагулянтной активностью, усиливать небольшую активность тромбоцитов; тип II обусловливает спорадические, изолированные случаи тяжелой тромбоцитопении с поздним началом, иммуноспровоцированные и часто ассоциирующиеся с катастрофическим тромбозом.
В основе лечения тромбофилических состояний и ДВС-синдрома лежит устранение непосредственной причины их возникновения (например, антибиотикотерапия при гнойно-септических процессах), а также воздействие на основные звенья патогенеза. Целый ряд состояний в акушерстве диктует необходимость проведения профилактических мер.
Показания к профилактике тромбоэмболических осложнений во время беременности и в послеродовом периоде:
• беременные в возрасте старше 35–40 лет
• беременные с экстрагенитальной патологией, особенно с заболеваниями сердечно-сосудистой системы и почек
• повторнобеременные с отягощенным акушерским анамнезом (гнойно-септические заболевания, антенатальная гибель плода, задержка развития плода, нефропатия, преждевременная отслойка нормально расположенной плаценты)
• наличие в анамнезе тромбозов и тромбоэмболий
• беременные, которым показана операция при беременности
• осложненное течение беременности, родов и послеродового периода: (нефропатия, преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, гнойно-септические заболевания, массивные гемотрансфузии)
• острые тромбозы и тромбоэмболии
• генетические формы тромбофилии.
Критериями противотромботической терапии в акушерской практике являются ее эффективность и безопасность для матери и плода. Из всего арсенала противотромботических средств (непрямые и прямые антикоагулянты, антиагреганты, тромболитики) препаратами выбора были и остаются гепарин натрий и его производные. В акушерской практике гепарин натрий занимает особое место в связи с немедленным антикоагулянтным эффектом, существованием антидота, легкостью управления дозой, отсутствием тератогенного и эмбриотоксического эффектов. Непрямые антикоагулянты проходят через плаценту и обладают тератогенным и эмбриотоксическим эффектами. В исключительных случаях их применение ограничено II триместром беременности, когда органогенез завершен.
Однако, несмотря на множество преимуществ, обычный нефракционированный или высокомолекулярный гепарин обладает рядом нежелательных побочных свойств, которые в основном предопределены его структурой. Нефракционированный гепарин (НГ) представляет собой смесь кислых макромолекулярных цепей сульфатированных анионов мукополисахаридов с высоковариабельной молекулярной массой от 4000 до 40 000 Д.
Вследствие гетерогенности структуры НГ имеет биодоступность лишь 30%, так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. Это чревато возникновением гепариновой иммунной тромбоцитопении в результате образования антител к этому комплексу (наиболее опасная форма тромбоза).
Одним из нежелательных эффектов гепарина натрия является истощение АТ III при длительном его применении в больших дозах, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина натрия в такой ситуации не приводит к антикоагулянтному эффекту.
Последние 5-7 лет в клиническую медицину активно внедряются низкомолекулярные гепарины (НМГ), зарекомендовавшие себя с лучшей стороны, так как в большинстве случаев проявляют большую противотромботическую активность и достоверно гораздо более низкую выраженность геморрагических осложнений и других побочных эффектов.
НМГ получают путем деполимеризации НГ, их молекулярная масса колеблется в пределах от 4 до 8 кД. Деполимеризацию можно осуществить химическим, ферментным и физическим методом (g-излучение).
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность, чем НГ (около 98%), больший период полужизни. НМГ меньше связываются с различными белками, клетками. В отличие от НГ их почечный клиренс значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). Кроме того, НМГ в гораздо меньшей степени, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию в плазме (в 2-4 раза дольше).
НМГ не обладают антитромбиновым свойством и, следовательно, не вызывают гипокоагуляции. Противотромботический эффект НМГ в основном зависит от его влияния на фактор Ха.
Однако если в состав НМГ входят фракции с молекулярной массой более 5400 Д, что эквивалентно более чем 18 дисахаридным остаткам, то также проявляется анти-IIa-активность. Так, у одного из наиболее ранних НМГ, надропарина кальция, молекулярная масса которого в среднем 4500 Д, благодаря фракциям с молекулярной массой больше 5400 Д соотношение анти-IIa- и анти-Ха-активности равно 1:4.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-PA; кроме того, они меньше подвержены действию антигепаринового фактора IV тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Прогресс в области гемостазиологии показал, что в генезе большинства тромботических явлений огромную роль играют активация внешнего пути свертывания и выделение в кровь тканевого фактора (ТФ). Этот механизм преобладает во время беременности, в перинатальном, послеоперационном периодах, при гнойно-септических заболеваниях, антифосфолипидном синдроме (АФС), ожирении, онкологических и множестве сердечно-сосудистых заболеваний, а также при ряде связанных с ними состояний: пороках сердца, кава-фильтре, чрескожной транслюминальной коронарной ангиопластике, тромбоэмболии легочной артерии, дистресс-синдроме легких, отслойке плаценты, эмболии околоплодными водами и др.
TFPI-фактор, или липопротеин-ассоциированный ингибитор коагуляции (LACI-фактор), является мощным естественным ингибитором внешнего пути свертывания. НМГ способны значительно повышать его уровень в крови. TFPI-фактор контролирует обусловленный фактором Ха механизм отрицательной обратной связи и ингибирует ряд комплексов, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина.
TFPI имеет и другие фармакологические свойства, как потенциальное антитромботическое средство: это ингибитор образования протеаз, прямой ингибитор фактора Ха и эластазы, ингибитор, обусловленный ТФ активации тромбоцитов и макрофагов; он взаимодействует с липопротеинами низкой плотности с изменением их патогенетической роли (особенно при атеросклерозе), взаимодействует с эндотелием сосудов, обеспечивает модуляцию эндогенных гликозаминогликанов, нейтрализует эндогенно образующийся ТФ.
В нормальных физиологических условиях TFPI синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов. Незначительные количества TFPI исходят из фибробластов, но при активации этих клеток уровнь TFPI повышается в 6-8 раз.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина. Если учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о применении НМГ у больных с дефицитом АТ III.
В отличие от НГ, благодаря меньшей молекулярной массе и большей биодоступности, НМГ дольше циркулируют в крови и обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Возможно однократное подкожное введение препарата в сутки: препараты не вызывают образования гематом в области инъекций.
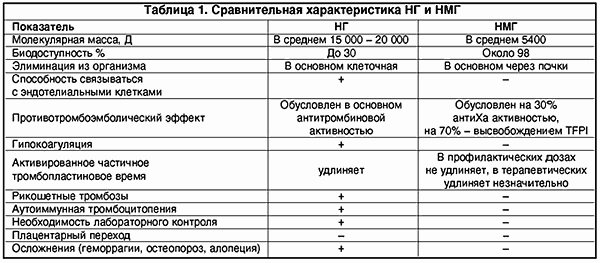
НМГ не вызывают гипокоагуляции, поскольку противотромботический эффект направлен на ингибцию Ха-фактора и внешнего пути свертывания крови; в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не обусловливают иммунных тромбозов (табл. 1).
Учитывая механизм действия НМГ и результаты их применения в широкой клинической практике, большинство исследователей считают, что нет необходимости в лабораторном контроле при использовании НМГ в профилактических целях. Тем не менее оценку их антикоагулянтного эффекта можно проводить по анти-Ха-активности. Биологические методы контроля терапии НГ и НМГ с учетом их действия на различные компоненты системы гемостаза представлены в таблице 2.
До появления НМГ контроль терапии преследовал цель обеспечения адекватной дозы НГ во избежание опасных геморрагических осложнений. При применении НМГ практически не существует проблемы гипокоагуляционных эффектов. Однако, весьма актуален контроль эффективности препарата. Для этой цели можно использовать такие маркеры тромбофилии, как комплекс тромбин-антитробмин, фрагмены F1+2 протромбина и особенно продукты деградации фибрина-фибриногена. Маркеры внутрисосудистого свертывания крови и тромбофилии представлены в таблице 3.
Установление отсутствия трансплацентарного перехода НМГ открыло большие возможности широкого применения его в акушерской практике, особенно у беременных с заболеваниями сердечно-сосудистой системы, с АФС и при ряде состояний, сопровождающихся тромбофилией и внутрисосудистым свертыванием крови. Преимущественное воздействие НМГ на внешний путь свертывания крови открывает заманчивую перспективу лечения эндотелиальных изменений при гестозах.
Положительным свойством НМГ (в частности, надропарина кальция) является купирование в течение 2-3 дней ДВС-синдрома у беременных с гестозами. Как правило, это сопровождается и регрессом заболевания. Однако если основные проявления гестоза не исчезают, то терапия НМГ более 1 нед нецелесообразна. Возможно, наблюдаемый положительный эффект НМГ у беременных с начальными формами гестоза обусловлен воздействием на эндотелий. Помимо стабилизирующего влияния антиагрегантов и антикоагулянтов, НМГ препятствуют экспрессии фактора Виллебранда на эндотелии.
Раствор Фраксипарина выпускается в одноразовых шприцах по 0,3, 0,4, 0,6, 1 мл. Это удобно в применении, инъекции безболезненны и не оставляют гематом. Препарат вводят под кожу брюшной стенки, что делает возможным его применение в амбулаторных условиях.
Таким образом, применение НМГ в акушерской практике открывает новые перспективы для эффективной профилактики и лечения тромбоэмболических осложнений, заболеваний, протекающих с ДВС-синдромом, а также шока и шокоподобных состояний.