Низкая степень злокачественности опухоли что это значит у женщин
Рак яичников
Классификация опухоли в яичниках выражается в трех типах: доброкачественная, пограничная и злокачественная.
Доброкачественные опухоли подразделяются на:
Опухоль способна вырабатывать гормоны, а может быть не активной.
Диагностировать рак яичников удается при использовании ультразвуковых исследований, а также компьютерной томографии. Постоянное наблюдение за состоянием органов половой системы у врача гинеколога позволяет женщинам обнаружить изменения и начать лечение на ранних стадиях.
Лечение доброкачественных новообразований начинается после определения размера опухоли, ее подвижности и локализации внутри яичника. В зависимости от возраста женщины, сопутствующих заболеваний принимается решение об удалении только опухоли или самого яичника. Доступная практика лапароскопического удаления новообразования позволяет снизить уровень осложнений, а также сократить срок восстановления после операции.
Пограничные опухоли
Такая модель опухолевого процесса включает в себя признаки и злокачественных, и доброкачественных опухолей. Особенность данного типа раковых клеток в том, что они не имеют развития.
Новообразования данного типа активно размножаются и поражают яичники, а также метастазируют в другие органы. Лечение такой опухоли определяются стадией развития заболевания и раннем обнаружении.
Виды опухолевого процесса в яичниках:
Причины рака яичников и факторы риска
Данный диагноз «рак яичников» преобладает у людей с генетической наследственностью и может возникнуть случайным образом. Причинами возникновения злокачественного образования является: не наступление беременности, употребление алкоголя и табака, большая масса тела, прием эстрогенной терапии, наступление ранней и поздней менструации. Также на практике существуют и профилактические факторы: прием оральной контрацепции, роды и кормление грудью перевязка маточных труб.
Классификация рака яичников
Существует первичное, вторичное и метастатическое поражение. Рак яичников первичного характера развивается непосредственно в железе. Опухоль развивается в эпителиальной ткани, преимущественно с двух сторон. Поражение первичным типом рака чаще проявляется у женщин в возрасте тридцати лет. Вторичный тип рака яичников развивается в тератоидных, серозных и псевдомуцинозных кистах яичника. Поражение случается у женщин шестидесяти лет. Метастатическое поражение случается из-за распространения раковых клеток через кровь, лимфу к другим органам. Опухоли данного типа отличаются быстрым развитием и поражением органов.
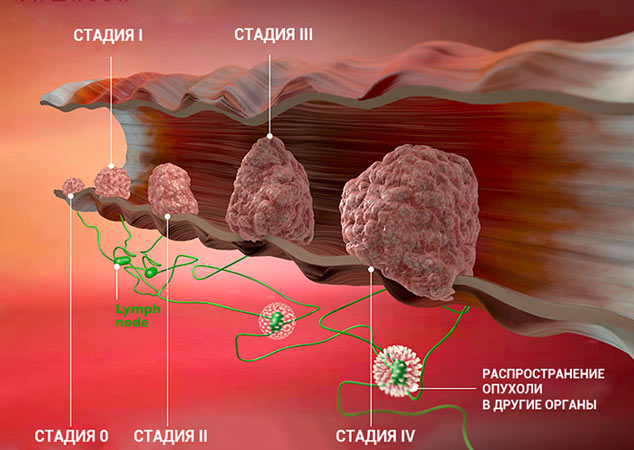
Стадии рака яичников
Стадийность заболевания зависит от развития и роста опухоли, а также попаданию раковых клеток в лимфу и кровь.
Диагностика рака яичников
Диагностика рака яичников начинается с консультации врача. При гинекологическом обследовании происходит ректовагинальный осмотр, который помогает оценить проникновение опухолевого процесса в ткани. Также происходит пальпация живота, позволяющая оценить размеры опухоли.
Описанные симптомы и анализ семейного анамнеза позволяют врачу выявить риск возможности появления рака яичников. Для подтверждения или опровержения заключения гинеколога назначается ультразвуковые и компьютерные исследования. А также лабораторные анализы на уровень онкомаркеров.
Лечения рака яичников
Одним из методов лечения рака яичников является хирургическое вмешательство. Частичное или полное удаление органа зависит от возраста пациента и метастазирования опухоли. Для молодых женщин возможна заморозка яйцеклетки перед операцией, что позволяет продуцировать будущую возможность материнства.
Химиотерапия при постановке диагноза «рак яичников» показывает положительную динамику. Пациенту назначается внутривенное вливание токсичных веществ, воздействующих на опухолевые клетки. Подавление развития онкологии в яичниках может сопровождаться нежелательными побочными эффектами, такими как, рвота, диарея, тошнота, артериальная гипертензия и мышечные, суставные боли. За решением данной проблемы и снятию симптомов необходимо обратиться с жалобами к лечащему врачу для изменения программы химиотерапии.
Реабилитация
Профилактикой в возникновении опухоли в яичниках является постоянный прием оральных контрацептивов.
Кликабельный ряд и телефоны
Филиалы и отделения, где лечат рак яичников
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Стадии рака
Все опухоли (или, на языке врачей — новообразования) делят на две большие группы: доброкачественные и злокачественные. Первые обычно не опасны для жизни, а вторые, если человек не получает лечения, приводят к гибели. В 2015 году от рака во всем мире умерло почти 9 миллионов человек.
Фатальность злокачественных опухолей связана с двумя их главными свойствами, которые, собственно, и отличают их от доброкачественных новообразований:
Для врача важно понимать, насколько сильно рак успел распространиться в организме пациента. Ведь от этого зависит лечение и прогноз. Для того чтобы упростить эту задачу и внести четкость, в течении каждого онкологического заболевания принято выделять определенные стадии.
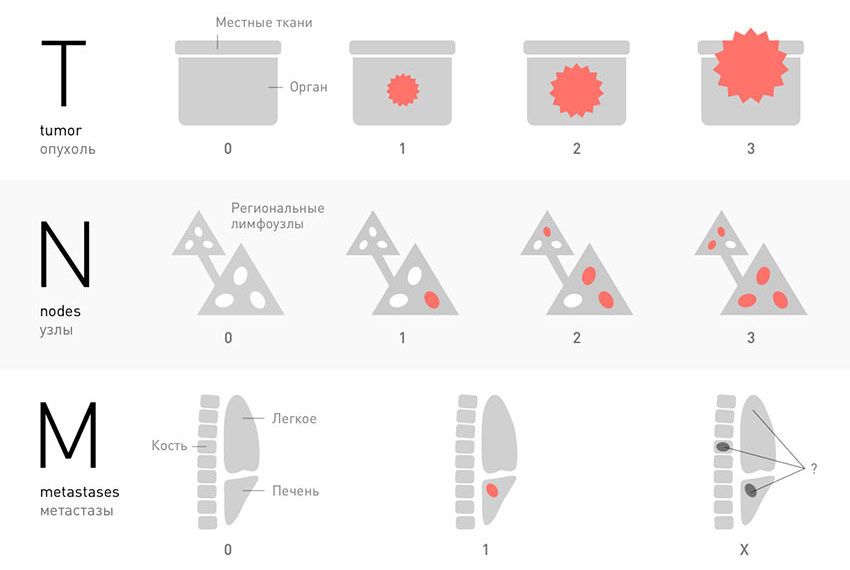
Классификация TNM
В большинстве случаев, для того чтобы установить стадию рака, ориентируются на три характеристики злокачественной опухоли, которые соответствуют трем буквам аббревиатуры TNM. К каждой букве приписывают индекс в виде цифры или специального обозначения.
T — tumor. Эта буква обозначает первичную опухоль, ее размеры, прорастание в стенку органа, соседние ткани:
N — nodus. Когда раковые клетки отрываются от первичной опухоли и мигрируют с током лимфы, в первую очередь они попадают в близлежащие (регионарные) лимфатические узлы. Можно сказать, что это первые баррикады на пути распространения рака в организме. В зависимости от того, обнаружены ли опухолевые клетки в регионарных лимфатических узлах, N может принимать значения:
M — metastasis. Эта буква показывает, обнаружены ли в теле больного отдаленные метастазы — вторичные очаги в различных органах:
Классификация TNM применима для большинства видов рака. Она позволяет очень подробно описывать злокачественные опухоли. В пределах основных групп выделяют подгруппы, их обозначают с помощью букв, например: T1a, T1b, T1c.
Однако, зачастую система TNM оказывается слишком громоздкой и не совсем удобной. Существует ее упрощенный вариант, когда возможные сочетания значений T, N и M сводят к пяти стадиям.
Стадии злокачественной опухоли
Часто онкологи обозначают стадию рака римской цифрой от I до IV. Эта классификация основана на TNM, но она проще и зачастую удобнее:
Это очень приблизительное описание стадий. Деление зависит от типа рака, от того, в каком органе он находится. Для того чтобы обозначить подстадию, к букве приписывают цифру. Например, стадия I может делиться на подстадии IA и IB.
Сторожевой лимфатический узел
Когда хирург оперирует онкологического пациента, зачастую ему приходится решать сложную задачу: стоит ли удалять регионарные лимфатические узлы? Если в них есть раковые клетки, и они будут оставлены в организме больного, произойдет рецидив. Если же удалить «чистые» лимфоузлы, это чревато осложнением в виде лимфедемы — отека на руке или ноге из-за нарушения оттока лимфы.
Раньше врачи нередко предпочитали меньшее из зол и удаляли лимфатические узлы «на всякий случай». Современные хирурги уже не действуют вслепую и могут более точно определить показания к лимфодиссекции. Это стало возможно благодаря появлению сентинель-биопсии или биопсии сторожевого лимфатического узла.
Сторожевым называется лимфатический узел (или группа лимфатических узлов), который первым принимает лимфу, оттекающую от злокачественной опухоли. Его можно обнаружить во время операции: для этого нужно ввести в опухоль флуоресцентный краситель или препарат с радиоактивной меткой. Препарат проникает в лимфатические сосуды, затем в сигнальный лимфоузел и «прокрашивает» его. Лимфатический узел удаляют и проверяют, нет ли в нем раковых клеток.
Для обозначения состояния сигнального лимфоузла используют специальную классификацию:
Если в сигнальном лимфоузле обнаружена опухолевая ткань — это показание к удалению регионарных лимфоузлов.
Степень злокачественности
Злокачественность и степень дифференцировки — два показателя, которые тесно взаимосвязаны. Они описывают внешний вид раковых клеток под микроскопом. Степень дифференцировки показывает, насколько раковая клетка отличается от здоровой. Если она высокая — опухолевая ткань похожа на здоровую. Низкодифференцированные раковые клетки полностью теряют сходство с нормальными.
Чем ниже степень дифференцировки и выше злокачественность, тем агрессивнее ведет себя рак и быстрее распространяется в организме. Для оценки используют гистологическую классификацию:
Шкала Глисона при раке простаты
Для того чтобы оценить степень злокачественности и агрессивности рака предстательной железы, используют шкалу Глисона, разработанную в 1960-х годах. В зависимости от того, как опухолевая ткань выглядит под микроскопом, ей присваивают оценку от 1 до 5. Чем ниже оценка, тем более высокодифференцированными и менее злокачественными являются клетки. Патологоанатом должен выявить два преобладающих типа ткани и выставить две оценки. Итоговая сумма баллов может колебаться от 2 до 10. Чем она больше, тем агрессивнее ведет себя опухоль, и выше риски.
Классификации рака печени
Классификация TNM не очень хорошо отражает течение злокачественных опухолей печени, поэтому в разных странах были созданы специальные классификации печеночно-клеточного рака. Например, многие врачи используют Барселонскую клиническую классификацию. В ее рамках выделяют следующие стадии рака печени:
В некоторых странах практикуется классификация итальянской программы по изучению рака печени (CLIP). В ней учитывается четыре фактора: состояние функции печени, распространение опухолевых очагов (больше или меньше половины печени), уровень альфа-фетопротеина (опухолевый маркер) и наличие тромбоза портальной вены. По каждому показателю врач выставляет оценку 0, 1 или 2 балла. Выживаемость пациентов зависит от суммы баллов:
В соответствии с системой CLIP, всех больных печеночно-клеточным раком можно поделить на две группы: 0–2 балла — значительно более благоприятный прогноз; более 2 баллов — значительно менее благоприятный прогноз.
В 1985 году была предложена классификация Okuda, в которой учитываются: степень поражения печени, наличие асцита (скопления жидкости в брюшной полости), изменение уровня альбумина и билирубина в крови. В соответствии с классификацией Okuda, выделяют три стадии рака печени:
Почему важно установить стадию злокачественной опухоли?
Знание стадии рака по TNM и другим системам помогает онкологу решать важные задачи:
Единые классификации помогают врачам из разных клиник и стран «разговаривать на одном языке». Видя стадию опухоли, диагностированную в другой клинике, онколог четко понимает, что это значит, и как дальше работать с пациентом.
Низкая степень злокачественности опухоли что это значит у женщин
Серозный рак низкой степени злокачественности составляет 5-10% от всех серозных раков и биологически и клинически отличается от серозного рака высокой степени злокачественности. По своим биологическим и клиническим свойствам он более похож на люминальный А подтип рака молочной железы. Он имеет индолентное течение, свидетельством чему является 5-летняя общая выживаемость 80% для всех стадий. Большинство опухолей экспрессирует рецепторы эстрогенов и прогестерона, хорошо отвечает на гормональную терапию и обладает меньшей чувствительностью к химиотерапии по сравнению с опухолью высокой степени злокачественности. Все это стимулирует разработку гормональной терапии для этого вида опухоли. Одновременно нельзя говорить, что рак низкой степени злокачественности резистентен к химиотерапии, которая до сих пор является стандартным подходом для лечения этих больных.
В связи с вышесказанным представляет интерес ретроспективное исследование, проведенное в M.D. Anderson Cancer Center (Хьюстон, Техас) у 203 больных серозным раком яичников низкой степени злокачественности II-IV стадий, получавших лечение с 1981 по 2013 гг. Всем больным была выполнена первичная циторедукция и проведено 6 курсов платиносодержащей химиотерапии (комбинацию производных платины и таксанов получили 81% больных). После окончания химиотерапии 70 больным была назначена поддерживающая гормонотерапия летрозолом (60% больных) или тамоксифеном (32%) в стандартных дозах. Еще 8% больным назначали агонисты LHRH отдельно или в комбинации с ингибиторами ароматазы, прогестины. Остальным 133 пациенткам после окончания химиотерапии рекомендовалось рутинное наблюдение каждые 3 месяца. Медиана продолжительности приема гормональных средств составила 33 мес. (1-232 мес.).
Медиана наблюдения за больными составила 71 мес. Медиана продолжительности времени до прогрессирования составила для больных в группе наблюдения 32,6 мес. и 64,9 мес. для больных группы поддержки (р
Современные подходы к терапии неходжкинских лимфом
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Н еходжкинские лимфомы (НХЛ) – это гетерогенная группа злокачественных лимфопролиферативных опухолей, отличающихся по биологическим свойствам, морфологическому строению, клиническим проявлениям, ответу на терапию и прогнозу. Традиционно в нашей стране для определения этой патологии использовался предложенный Р. Вирховым в середине прошлого века термин «лимфосаркомы», являющийся синонимом термина «неходжкинские лимфомы». Выделение различных вариантов НХЛ, основанное изначально только на морфологических особенностях опухолей, в настоящее время базируется на иммунофенотипических характеристиках опухолевых клеток и является комплексным, учитывающим клиническую картину и другие биологические особенности.
Пятилетняя выживаемость при НХЛ широко варьирует в зависимости от морфологического варианта опухоли: при В–клеточных лимфомах маргинальной зоны, MALT, фолликулярных она превышает 70%, что трактуется, как очень хороший прогноз, тогда как при Т–лимфобластных, периферических Т–клеточных НХЛ этот показатель ниже 30% [1].
НХЛ начинаются с появления одиночного опухолевого узла и распространяются путем лимфогенного и гематогенного метастазирования. Первичный опухолевый очаг может локализоваться в лимфатических узлах (нодальное поражение) или в других органах и тканях (экстранодальное поражение). Клинические проявления обусловлены расположением опухолевых очагов. Отмечается отчетливая разница в частоте поражения разных органов и тканей: медиастинальных лимфоузлов – 15–25% (реже, чем при лимфогрануломатозе), легких – 3–6%, селезенки – 30–40%, печени – 15–50%, костей – 5–15%, желудочно–кишечного тракта – 10–24%, костного мозга – 30–40%.
Клинический вариант заболевания с исходным локализованным поражением экстранодальных органов и тканей определяется, как первичная экстранодальная НХЛ. Частота поражения разных органов и тканей при этом неодинакова: наиболее часто изолированно вовлекается желудочно–кишечный тракт (24,3%), кольцо Пирогова–Вальдейера (19,4%), головной мозг (10%), значительно реже – молочная железа (2,0%), легкие, плевра (1,1%) [2].
Опухоли весьма разнообразны по прогнозу: к благоприятным вариантам (5–летняя выживаемость выше 60%) относятся первичные НХЛ желудочно–кишечного тракта, кольца Пирогова–Вальдейера, орбиты, слюнных желез, легких; в противоположность этому высокой злокачественностью течения отличаются первичные лимфомы яичка и яичников, костей, молочной железы, ЦНС.
На основании тщательного изучения всех проявлений НХЛ было установлено, что наиболее значимыми факторами неблагоприятного прогноза являются: возраст старше 60 лет, повышение уровня ЛДГ (2–хкратное и более), общее состояние больного, соответствующее 2–4 степени (ECOG), III–IV стадия болезни, наличие более одного экстранодального очага поражения, вовлечение костного мозга. Это было положено в основу Международного прогностического индекса – МПИ [3].
На основании количества имеющихся неблагоприятных факторов прогноза выделяют 4 степени риска раннего прогрессирования болезни:
• низкая – отсутствие или присутствие лишь одного неблагоприятного признака,
• низкая/промежуточная – наличие 2 факторов,
• промежуточная/высокая – наличие 3 факторов
• высокая – наличие 4 факторов.
Наличие двух и более факторов отчетливо отрицательно сказывается на прогнозе заболевания независимо от морфологического варианта опухоли. Именно это, в определенной мере, и объясняет условность принятого разделения НХЛ по степени злокачественности, так как прогноз существенно изменяется внутри одного варианта опухоли в зависимости от степени риска (например, при диффузной крупноклеточной В–клеточной НХЛ 5–летняя выживаемость при низкой степени риска равна 72%, а при высокой – 22%, значительно отличаясь от усредненного показателя – 45%).
Coiffier [4] убедительно продемонстрировал влияние на 5–летнюю выживаемость неблагоприятных факторов прогноза, отрицательное значение которых отмечается при всех морфологических вариантах НХЛ (табл. 1).
Определение группы риска не является в настоящее время стандартным критерием для выбора терапии, но предполагает возможность ее интенсификации на всех этапах развития болезни.
Разделение всех морфологических вариантов по степени злокачественности остается обоснованным требованием клиницистов. С момента публикации Рабочей Формулировки (1980 г.) осуществлялось деление всех вариантов НХЛ по трем степеням злокачественности – низкая, промежуточная, высокая. Вариабельность прогноза при НХЛ промежуточной степени легла в основу нового деления (1999 г.) неходжкинских лимфом по прогнозу, в котором выделяются опухоли с благоприятным прогнозом (низкая степень злокачественности), агрессивные и высокоагрессивные НХЛ (высокая степень злокачественности). «Агрессивные» НХЛ соответствуют привычному термину «НХЛ с промежуточным прогнозом». Такое деление значительно более полно отражает различные клинические варианты опухоли [5]. Для клиницистов истинное практическое значение имеет деление на благоприятные опухоли и высокоагрессивные, принципиально отличающиеся друг от друга.
Опухоли низкой степени злокачественности характеризуются медленным прогрессированием, длительной выживаемостью (годы), умеренной чувствительностью к химиотерапии и отсутствием возможности излечения при использовании стандартной химиотерапии. В эту группу включены следующие варианты НХЛ (в соответствии с REAL классификацией):
• фолликулярная НХЛ (I, II степени)
• диффузная лимфоцитарная НХЛ
• НХЛ маргинальной зоны:
а. MALT– экстранодальная
б. моноцитоидная – нодальная
• грибовидный микоз/синдром Сезари.
Значительных различий в выживаемости внутри этой группы не выявлено.
Высокоагрессивные лимфомы быстро прогрессируют, выживаемость составляет лишь месяцы, они умеренно– и высокочувствительны к химиотерапии и могут быть излечены стандартными методами химиотерапии. Однако внутри этой группы НХЛ выявляются весьма значимые различия в продолжительности жизни: 5–летняя выживаемость колеблется от 78% при анапластической крупноклеточной лимфоме до 14% при лимфоме зоны мантии, в то время как при диффузной В–крупноклеточной лимфоме и III степени фолликулярной лимфомы этот показатель равен 38% и 68% (соответственно). В эту группу включены следующие варианты:
• диффузная крупноклеточная НХЛ
• НХЛ Беркитта и Беркиттоподобные опухоли
• периферические Т–клеточные НХЛ
• анапластическая крупноклеточная НХЛ
Промежуточное положение занимают такие опухоли, как фолликулярные III степени и зоны мантии. Отнесение НХЛ зоны мантии к разным степеням злокачественности (промежуточной или высокой), встречающееся в современной литературе, объясняется недостаточным клиническим опытом, этапом набора информации, обобщение которой позволит более точно определить положение этого варианта НХЛ. В целом отнесение к этой группе конкретных вариантов лимфом затруднено из–за большого разнообразия характеризующих их параметров.
Для лечения НХЛ применяются все виды противоопухолевой терапии. Основными факторами, влияющими на выбор терапевтической тактики, являются: распространенность процесса (клиническая стадия – I–II или III–IV), морфологический вариант опухоли, первичная или преимущественная локализация опухолевого поражения, факторы прогноза.
Хирургическое лечение используется с наименьшей частотой. Основным показанием являются первичные одиночные опухоли желудочно–кишечного тракта. Спленэктомия выполняется редко, обычно с целью коррекции гематологических показателей при выраженном гиперспленизме (что нередко сочетается со специфическим поражением селезенки).
Лучевая терапия является высокоэффективным методом лечения НХЛ, может использоваться на всех этапах болезни, хотя возможности ее неодинаковы. В качестве самостоятельного метода лечения применяется редко, но с успехом сочетается с другими лечебными воздействиями, особенно химиотерапией. Большое распространение получила комбинированная (химио–лучевая) терапия начальных (I–IIА) стадий НХЛ.
При этом оказалось, что комбинированная терапия высоко эффективна при любом морфологическом варианте НХЛ: частота полной ремиссии (ПР) превышает 90%, 5–7 летняя безрецидивная выживаемость составляет 63%–82% [6, 7]. Результаты несколько лучше при I стадии и опухолях низкой степени злокачественности.
При большинстве клинических проявлений НХЛ основным лечебным мероприятием является химиотерапия – как в виде самостоятельного метода, так и в сочетании с другими терапевтическими подходами.
Продолжительность жизни больных НХЛ высокой степени злокачественности находится в прямой зависимости от результатов лечения: 5–летняя выживаемость при достижении полной ремиссии составляет 50%, в то время как при частичной ремиссии она равна лишь 15%. Это обусловливает необходимость проведения активной интенсивной терапии при НХЛ высокой степени злокачественности сразу с момента установления диагноза с целью достижения максимального эффекта – полной ремиссии. При лимфомах низкой степени злокачественности менее выражена зависимость продолжительности жизни от эффективности лечения: 5–летняя выживаемость превышает 80% независимо от достижения полных или частичных ремиссий.
Комбинированная химио–лучевая терапия III стадий не превосходит по результатам одну химиотерапию, а при IV стадиях малоэффективна, т.к. облучение отдельных доступных зон носит паллиативный характер. Основным методом лечения распространенных форм НХЛ является химиотерапия, интенсивность которой зависит от степени злокачественности опухоли и клинических проявлений.
НХЛ низкой степени злокачественности
Наиболее распространенным вариантом НХЛ низкой степени злокачественности являются фолликулярные опухоли (I, II степени). Большое разнообразие терапевтических воздействий (монохимиотерапия, полихимиотерапия, использование моноклональных антител и альфа–интерферона, противоопухолевых вакцин, аутологичной и аллогенной трансплантации костного мозга – ТКМ) и их умеренная эффективность доказывают, что пока не найден наилучший терапевтический метод. Несмотря на различные модификации терапии, за последние 40 лет не удалось принципиально изменить результативность лечения [8].
При медленно прогрессирующих опухолях в течение длительного времени может с успехом использоваться монохимиотерапия, преимущественно алкилирующими препаратами. При умеренном увеличении лимфатических узлов и лимфоидной инфильтрации костного мозга, не сопровождающейся анемией и тромбоцитопенией, монохимиотерапия эффективна более чем у 80% больных; частота полных ремиссий варьирует от 25 до 60%. Препаратами первой линии являются лейкеран и циклофосфан.
I степень фолликулярной НХЛ при наличии таких клинических проявлений, как большие размеры опухолевых масс, сдавление жизненно важных органов с нарушением их функции, тенденция к быстрому увеличению опухолевых образований, выраженная лимфоидная инфильтрация костного мозга (>50%) и II степень фолликулярной лимфомы, независимо от выраженности клинических проявлений, являются показанием к использованию полихимиотерапии в качестве I линии лечения. Наибольшее распространение получили схемы LVPP и COP; схеме СОР следует отдавать предпочтение при исходной тромбоцитопении.
Однако общая тенденция лечения лимфом низкой степени злокачественности в последнее время заключается в интенсификации I линии терапии. Это основано на возможности достижения у большего числа больных полных и более продолжительных ремиссий. Первые полные ремиссии на 2 года превосходят последующие по длительности. Достижение первой ПР путем использования полихимиотерапии с антрациклинами обеспечивает 3–х летнюю медиану безрецидивной выживаемости; следует обратить особое внимание на то, что у 1/6 больных полная ремиссия может сохраняться более 10 лет [10]. Поэтому наибольшее распространение получило применение схемы СНОР и ее вариантов в качестве I линии терапии.
Все шире в схемах полихимиотерапии в последнее время стали использоваться при лимфомах низкой степени злокачественности митоксантрон и флюдарабин. В качестве I линии терапии больных с благоприятным прогнозом наибольшее распространение получила комбинация МСР (митоксантрон – 14 мг/м 2 однократно в первый день, лейкеран – 6 мг/м 2 с 1–го по 10 день и преднизолон – 25 мг/м 2 с 1–го по 10 день), которая все чаще заменяет схему СОР. При наличии неблагоприятных факторов прогноза на первом этапе индукционной терапии используются комбинации МАР (митоксантрон, цитарабин, преднизолон), OPEN (винкристин, преднизолон, этопозид, новантрон), NOPP (новантрон, винкристин, натулан, преднизолон), MVLP (митоксантрон, тенипозид, лейкеран, преднизолон). Приведенные принципы используются при всех вариантах НХЛ низкой степени злокачественности.
При выявлении резистентности к адекватной терапии I линии и лечении рецидива целесообразно применение полихимиотерапии, стандартно используемой при лимфомах высокой степени злокачественности – схема СНОР, ее варианты и другие комбинации цитостатиков. Однако возможности повторного лечения фолликулярной лимфомы неодинаковы: лечение I рецидива уступает по эффективности терапии первичных больных (длительность ремиссии в 3 раза меньше, а выживаемость в 2 раза короче): после индукционной терапии лейкераном или СОР (CVP) результативность терапии I рецидива на 20% выше, чем последующих; а ремиссия в 2 раза продолжительней (табл. 2) [12].
Обсуждается целесообразность использования пуриновых производных в качестве терапии II линии (в частности, наибольший опыт накоплен в отношении Флюдары). Перспективность применения флюдарабина при III–IV стадиях НХЛ низкой степени злокачественности не вызывает сомнений. Эффективность препарата неодинакова при применении на разных этапах болезни: при рецидиве заболевания и у рефрактерных к I линии терапии пациентов она составляет 40% (30–71%) при частоте полных ремиссий 11% (4%–12%); использование же препарата в качестве I линии у нелеченных больных более результативно: общий эффект – 59% (44–87%) при двукратном увеличении частоты ПР – 22% (9–50%). Обнадеживающими можно считать предварительные данные об использовании у рефрактерных больных сочетания флюдарабина и митоксантрона (при результативности выше 90% ПР отмечены в 56–67%). Комбинация FМD (флюдара – 25 мг/м 2 три дня, митоксантрон – 10 мг/м 2 в 1 день, дексаметазон – 5 дней) позволяет достичь ПР у 43–47%, частичные ремиссии (ЧР) – 29–47%; следует подчеркнуть, что при достижении ПР в 82% обнаружены молекулярные ремиссии и в 84% ПР сохранялись в течение 2 лет. Неблагоприятным фактором является наличие больших опухолевых масс. Учитывая спектр токсических проявлений Флюдары, следует отдавать предпочтение назначению ее больным моложе 60 лет. У больных с высоким риском раннего прогрессирования (наличие одновременно более 3 неблагоприятных факторов прогноза) полихимиотерапия с включением Флюдары может привести к элиминации опухолевого клона с t(14; 18).
Значительно менее изучены возможности пентостатина (DCF) и кладрибина (2 Cda) при НХЛ. В качестве схем II линии терапии рефрактерных больных и лечения ранних рецидивов следует также использовать комбинации с митоксантроном (CEMP, CEPP(B), MEPD, MIV, N–BECOP, VEMP) и стандартные схемы I и II линии терапии НХЛ высокой степени злокачественности.
Менее изучена, но, бесспорно, весьма перспективна терапия моноклональными антителами (МКА). С момента первых исследований П. Эрлиха в области иммунологии (1900 г.) до разработки технологии получения МКА (Kohler, Milstein, 1975) прошло более семи десятилетий, и только в 1984 году после идентификации Nadler CD20 (1980) появилась реальная возможность антиидиопатической терапии МКА В–клеточных НХЛ. Последующее развитие этого направления позволяет в настоящее время констатировать наличие МКА, объектом воздействия которых являются все характерные для В–клеточных НХЛ низкой степени злокачественности кластеры дифференцировки. Первым анти–CD20 МКА стал Rituximab (торговое название – Mabthera), который был зарегистрирован в США в конце 1997 г., как первый МКА для лечения рака.
Более 90% В–клеточных НХЛ экспрессируют CD20, который присутствует на нормальных и злокачественных пре–B и зрелых В–клетках, но не обнаружен на гемопоэтических стволовых клетках, про–В–клетках и нормальных плазматических клетках. Терапия анти–CD20 МКА – это лечебное воздействие, обладающее уникальным механизмом действия: прямая индукция апоптоза и усиление комплемент– и антителозависимой цитотоксичности, тумороспецифичность и способность снижать токсичность лечебного средства относительно клеток «хозяина».
Основными показаниями к использованию мабтера являются НХЛ низкой степени злокачественности: монотерапия рефрактерных опухолей и рецидива болезни при неблагоприятном прогнозе (большие опухолевые массы, развитие рецидива после АТКМ): эффективность 50% (ПР – 4%, ЧР – 44%), медиана безрецидивного периода – почти год (11,8 мес) (результаты III фазы исследования). Эти возможности уже подтверждены отечественным опытом: мабтера в режиме монотерапии оказалась достаточно результативной: общий эффект – 48% (ПР – 22%, ЧР – 26%) [27].
Накоплен опыт использования мабтера для лечения рецидивов после Salvage–терапии, применения в сочетании с высокодозной химиотерапией с ТКМ (в период подготовки с целью биологической очистки, на завершающем этапе – для воздействия на резидуальную болезнь), апробирована монотерапия мабтера в качестве I линии фолликуляроной НХЛ, при резистентных формах лептоменингеальных поражений ЦНС, при НХЛ высокой степени злокачественности в сочетании с СНОР, при болезни Вальденстрема.
Интересны сведения об использовании мабтера в сочетании с режимом СНОР – схема R–СНОР. M. Czuczman показал реальный шанс повышения эффективности до 100% (ПР – 63%, медиана ПР – 20 мес) при использовании схемы R–СНОР в I линии фолликулярной НХЛ с неблагоприятными факторами прогноза. Но еще более впечатляющими являются результаты исследования GELA, наглядно демонстрирующие, что мабтера перспективна не только для зрелоклеточных НХЛ; добавление мабтеры к схеме СНОР (в виде однократного введения в стандартной дозе 375 мг/м 2 при проведении каждого курса) достоверно увеличило эффективность «золотого стандарта» НХЛ высокой степени злокачественности у пожилых больных: сравнение схемы СНОР и R–СНОР у 328 больных (более половины в возрасте более 70 лет) показало увеличение общей эффективности до 82% по сравнению с 66%, а частоты ПР до 76% против 60%. Расширение терапевтических возможностей сочеталось со снижением летальности в группе R–СНОР (5% по сравнению с 7%). Это убеждает в правильности обоснованно сложившегося мнения о том, что Мабтера способна увеличивать толерантность к химиотерапии даже при интенсифицированных режимах. Свидетельством тому является использование препарата при почечной дисфункции, у пожилых больных. Отсутствие привычной миелосупрессии сделало возможным использовать Мабтера не только при тромбоцитопении, но и с целью лечения индуцированного флюдарабином, в частности, снижения количества тромбоцитов. Лечебная доза – 375 мг/м 2 ; препарат вводится в виде 4–часовой в/в инфузии один раз в неделю на протяжении не менее 4 недель.
НХЛ высокой степени злокачественности
Клиническими особенностями НХЛ высокой степени злокачественности является быстрый рост опухолевых образований и склонность к раннему прогрессированию. Основным лечебным подходом при III–IV стадиях является полихимиотерапия. При агрессивных диффузных крупноклеточных В–клеточных НХЛ отмечен высокий уровень экспрессии гена множественной лекарственной устойчивости, который выявляется у 10–20% первичных больных и в 50–70% при развитии рецидива. Поскольку задачей лечения является достижение полной ремиссии, использование монохимиотерапии (высокие дозы циклофосфана – 40–45 мг/кг или мелфалана – 1,0–1,5 мг/кг) допустимо лишь в тех случаях, когда есть противопоказания к стандартной адекватной полихимиотерапии.
Первой линией терапии диссеминированных НХЛ высокой степени злокачественности является схема СНОР (циклофосфамид, доксорубицин, винкристин, преднизолон), признанная «золотым стандартом»: при общей эффективности выше 80% частота полных ремиссий равна 50–55%. Наиболее чувствительна диффузная крупноклеточная лимфома (частота ПР – 58–62%). Двухлетнее безрецидивное течение отмечается у 70–80% больных [13]; анализ отдаленных результатов (сроки наблюдения 14 лет и более) показал, что 32% первичных больных могут быть излечены [14]. С другой стороны, было установлено, что рецидивы возникают с уменьшающейся частотой на протяжении первых 7 лет, а результативность находится в прямой зависимости от возраста: частота ПР и медиана выживаемости значительно ниже у лиц старше 60 лет (37% и 16 мес) по сравнению с больными моложе 40 лет (65% и 101 мес) [15]. Это послужило основанием для разработки и сравнительной оценки более интенсивных терапевтических подходов на этапе первой линии индукционной терапии.
Токсичность высокодозной СНОР–терапии требует оправданности ее использования, а строго выверенных показаний к ее применению в качестве I линии терапии пока не выработано. Наиболее убедительными показаниями следует считать наличие одновременно нескольких неблагоприятных факторов прогноза, так как анализируя эффективность стандартной химиотерапии I линии у 2031 больного, Shipp M.F. (1993) установил снижение частоты ПР и 5–летней выживаемости более чем на 30% при наличии у больных в момент начала лечения 3 и более неблагоприятных факторов прогноза (табл. 3) [16].
Попытка улучшения эффективности СНОР осуществлялась и за счет замены доксорубицина на другие цитостатические агенты. Установлено, что в целом, в качестве I линии это нецелесообразно; однако использование схемы CIOP (циклофосфан, идарубицин, винкристин, преднизолон) рекомендуется пожилым больным на первом этапе лечения (равная эффективность сочетается с меньшей кардиотоксичностью), а комбинацию СNOP (замена доксорубицина на митоксантрон) следует использовать в качестве II линии терапии (она не обладает перекрестной резистентностью с СНОР и переносима в любом возрасте). Разработана 2–недельная модификация СНОР для лиц пожилого возраста (старше 70 лет) с заменой адриамицина на фарморубицин [17]: циклофосфан по 500 мг + фарморубицин (эпирубицин) 30 мг + винкристин 1 мг + декортин 120 мг – в 1, 8, 15 дни
Однако исторически события развивались по–другому. Вслед за внедрением схемы СНОР появился опыт использования режимов второго поколения – М–ВАСОД (высокая доза метотрексата с лейковорином, блеомицин, адриамицин, циклофосфамид, онковин, дексаметазон), предложенный в 1975 году и третьего поколения – proMACE–MOPP, proMACE–cytaBOM и MACOP–B.
Высокая токсичность первоначальной модификации M–BACOD за счет высокой дозы метотрексата (3000 мг/м 2 ) потребовала перехода на использование его в средних дозах (200 мг/м 2 ) – схема m–BACOD. Применение m–BACOD позволило достичь ПР в 61%, у 76% больных медиана безрецидивного течения составила 3,6 лет. Расчетная 1, 3 и 5–летняя выживаемость равна 80%, 63% и 60%, соответственно [18]. При достижении ПР 5–летний безрецидивный период отмечен у большинства пациентов – 74%. Основными проявлениями токсичности были мукозиты (44%) и пульмониты (18%) при очень высокой токсичности в целом (97%). Фатальная токсичность составила 8% и была обусловлена прогрессирующим блеомициновым пульмональным фиброзом и сепсисом в период длительной нейтропении. Безусловно положительным фактором было снижение риска развития рецидивов с поражением ЦНС при исходном вовлечении костного мозга; поражение костного мозга значительно ухудшало результаты – 3–летняя выживаемость в 2 раза меньше (29% по сравнению с 61% при интактном костном мозге); обращало на себя внимание и то, что не удалось уменьшить число ранних рецидивов (в первые два года) [19]. Другим направлением было совершенствование комбинации pro–MACE (циклофосфан, адриамицин, этопозид, преднизолон, высокая доза метотрексата) за счет добавления схемы МОРР или компонента cyta–BOM (цитарабин, блеомицин, винкристин, метотрексат) [20], основанное на развитии гипотезы Goldie– Coldman о преодолении резистентности при увеличении количеcтва используемых противоопухолевых агентов. МОРР использовался в качестве консолидации после нескольких (3 или 4) месяцев лечения. Схема proMACE–cytaBOM обладала большей интенсивностью (на 25% превосходя proMACE–МОРР) [21] и результативностью: частота ПР колебалась от 65 до 80%, 50% больных не имели признаков заболевания в течение трех лет [22]. Фатальная токсичность составила 8%. Группа канадских исследователей предложила комбинацию МАСОР–В – непрерывное 12–недельное лечение, включающее доксорубицин, циклофосфан, винкристин, блеомицин и умеренные дозы метотрексата с фолиниевой кислотой [23]: ПР отмечены в 84%, 3–летняя выживаемость – 67%, 8–летняя выживаемость – 62%, а 8–летняя безрецидивная выживаемость составила 52%. Однако основной трудностью терапии стала высокая частота мукозитов (50–75%); тяжелые инфекционные осложнения встречались у 11% больных, а токсическая летальность – у 6–7% [24, 25]. Таким образом, создание и использование схем второго и третьего поколения продемонстрировало возможность увеличения эффективности при одновременном отчетливом увеличении токсичности. Это потребовало целенаправленного сравнительного изучения в рандомизированных исследованиях эффективности схем второго и третьего поколения со схемой СНОР, итогом которых явилось заключение о целесообразности применения в качестве I линии терапии диффузной крупноклеточной и иммунобластной НХЛ схемы СНОР (равноценной по эффективности и менее токсичной) и использования многокомпонентных режимов второго и третьего поколения на II и последующих этапах лечения (табл. 4) [26].
Для повторного лечения предложен также ряд схем полихимиотерапии, включающих препараты, которые редко применяются на первых этапах лечения: цитозар (HOAP–Bleo, MAP, PAC), цисплатин (CEMP, MEPD, PEB), ифосфамид (VIM, MIV), метил–гаг (MIME, VIMMM), этопозид и митоксантрон (CEPP[B], OPEN, VEMP, BACOD–E). Эти комбинации могут использоваться в высоких и повышенных дозах (ASAP, ESAP, DHAP). Эффективны и схемы с аспарагиназой – LOP, LOAP. Они бесспорно перспективны при лейкемической трансформации костного мозга по типу ОЛЛ, но кроме того, оказывают заметное положительное действие при рецидивах распространенных диффузных крупноклеточных НХЛ.
Эффективность повторного лечения заметно ниже первичного. Она зависит во многом от результатов предыдущей терапии, срока наступления, длительности и полноты ремиссии. При рецидивах, особенно первых, можно получить повторные ремиссии у 70–80% пациентов, из них у 30–35% – полные. В противоположность этому преодолеть первичную резистентность довольно трудно: ремиссии удается получить лишь у 1/3 больных и из них лишь в 8–10% – полные. Безусловно прогностически более благоприятным является первый рецидив, результаты лечения отчетливо лучше, но зависят от срока его наступления: терапия раннего рецидива (развившегося в первые 6 мес) значительно менее результативна по сравнению с лечебными возможностями «позднего» рецидива (выявленного спустя 1 год и более после завершения терапии). При позднем рецидиве допустима попытка использования лечения, оказавшего длительный положительный эффект; напротив, ранний рецидив всегда диктует необходимость смены терапии. На результативность повторного лечения оказывает влияние и эффективность предшествующей терапии. T. Philip показал отчетливую разницу в эффективности лечения рецидива, развившегося после завершения эффективного лечения (ПР или ЧР) и возникшего на фоне продолжающейся терапии – общая эффективность составила 62% у чувствительных больных по сравнению с 22% при резистентности. А в работах Г.В. Кругловой (1997 г.) установлено, что более чувствительными являются локальный рецидив и рецидив с возобновлением роста ранее выявляемых опухолей по сравнению с появлением новых очагов поражения.
Еще большую проблему составляет терапия 2–го, 3–го рецидивов и первично–рефрактерных больных. Для этой категории пациентов применение стандартных доз противоопухолевых агентов бесперспективно и целесообразна интенсификация режимов, т.е. использование интенсивной терапии спасения (Salvage–Therapy). Опыт ее использования в нашей стране, к сожалению, невелик, в то время как по международным меркам стандартная терапия в этих клинических случаях считается паллиативной, используется с частотой не более 20%, а основным видом помощи является высокодозная химиотерапия. Однако при этом необходима правильная трактовка понятия первичной рефрактерности и резистентного и чувствительного рецидива. Отсутствие ответа на общепринятую адекватную терапию I и II линии позволяет говорить о первичной резистентности опухоли. Клинические признаки первичной резистентности: уменьшение опухолевых проявлений менее чем на 50%, сохранение размеров опухолевых узлов, увеличение опухолевых образований, появление новых опухолевых проявлений болезни, уменьшение размеров опухолевых образований на срок менее 1 месяца, отмечаемые в процессе проведения адекватной терапии. Достижение ЧР или ПР на фоне проведения общепринятой терапии означает наличие у больного чувствительного рецидива, а отсутствие эффекта – нечувствительного возврата болезни. Неэффективность повторного лечения означает наличие вторичной резистентности.
Современная лекарственная терапия – это эффективный арсенал помощи больным, страдающим неходжкинскими лимфомами. Выбор правильной лечебной тактики должен осуществляться профессионалом–онкогематологом с учетом всех параметров, характеризующих заболевание на разных этапах его развития.
1. Armitage J. Lymphomas, Edited by G. Canellos, T.A. Lister, J.L. Sklar – 1 st ed., W.B. Saunders Company, 1998, pp. 439–449.
2. Sutcliffe S., Gospodarowicz M. Localized extranodal lymphomas. In Keating A., Armitage A., Burnett J. Newland A [eds]: Haematological Oncology, Cambridge, Cambridge – Medical Reviews, 1992, pp. 189–222
3. Shipp M.A., 1993 N. Engl. J. Med. 1993; 329:987
5. Hiddemann W., Ann. Onc., 1999, 10 (sup. 3): abs. 016
6. Круглова Г.В., Финогенова И.А. Новое в онкологии,сборник научных трудов под. ред. И.В. Поддубной, Н.А. Огнерубова, выпуск 2, Воронежский университет, 1997, стр. 6–11
7. Jones S.E., Fuks Z., Bull M. et al., Cancer 1973; 31:806
8. Armitage J. Lymphomas, Edited by G. Canellos, T.A. Lister, J.L. Sklar – 1 st ed., W.B. Saunders Company, 1998, pp. 439–449.
9. Aviles А., Duque G. Leukemia and Lymphoma, 1996; 20(5–6): 495–499.
10. Unterhalt M., Herrmann R., Nahler V., et al., Blood, 1996; 86(10): А–1744, 439а.
11. Hagenbeek A., Carde P., J. Clin. Oncol., 1998; 16(1): 41–47.
12. Weisdorf D.J., Andersen J.W., Glick J.H. et al. J. of Clin. Oncology 1992; 10(6):942–947
13. DeVita V.T., Canellos G.P., Chabnes B. et al., Lancet, 1975; 1:248
14. Coltman C.A., Dahlberg S., Jones S.E. Excerpta Medica, 1988; pp. 194–202
15. Diette K.M., Caro W.A., Roenigk H.H. J. Am. Acad. Dermatol., 1984; 10:896
16. Shipp M.A., 1993 N. Engl. J. Med. 1993; 329:987
17. Cavalli F. Proc. ASCO, 1995, abs. 714
18. Gaynor E.R., Ficher R.I., Lymphomas, Edited by G. Canellos, T.A. Lister, J.L. Sklar – 1 st ed., W.B. Saunders Company, 1998, pp. 399–413
19. Dana B.W., Dahlberg S., Miller T. et al., J. Clin. Oncology, 1990; 8:1155
20. Fisher R.T., DeVita V.T., Hubbard S.M. et al., Ann. Intern. Med., 1983; 98:304
21. Longo D.L., DeVita V.T., Duffey P.L. J. Clin. Oncol., 1991; 9:25
22. Miller T.P., Dahlberg S., Jones S.E. et al., Proc. Am. Soc. Clin. Oncol., 1987; 6:197a
23. Connors J.M., Klimo P. Semin. Hematol., 1988; 25:41
24. O`Reilly S.E., Hoskins P., Klimo P. Ann. Oncol. 1991; 2:17
25. Weick J.K., Dahlberg S., Fisher R.I. et al., J. Clin. Oncol., 1991; 8:748
26. Fisher R.T., DeVita V.T., Hubbard S.M. et al., Ann. Intern. Med., 1983; 98:304