Нитрат серебра это что в химии
Нитрат серебра (Азотнокислое серебро)
Нитрат серебра это бесцветные кристаллы которые очень быстро растворяются в воде и некоторых других растворителях, обладает токсичными свойствами.
Попадание на открытую кожу образует при длительном контакте химический ожог, при недолгом некоторое потемнение кожи от синевато фиолетового до черного цвета.
Именно поэтому получил название (адский камень), другое название : азотно-кислое серебро, ляпис (от слова камень).
Почти во всех реакциях проявляет окислительные свойства, признак реакции с нитратом серебра и хлоридом натрия, а также соляной кислотой это белый творожистый осадок хлорида серебра.
Который сереет на свету связи частичного восстановления серебра.
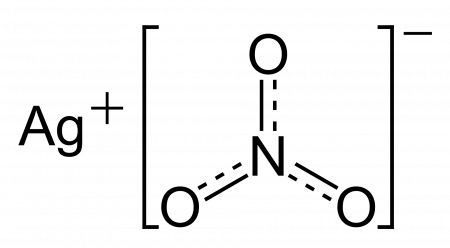
Нитрат серебра AgNO3
Что такое нитрат серебра это неорганическое соединение, соль серебра, очень реакционно способное вещество (образует химические ожоги при попадания на кожу), как и все нитраты проявляет окислительные свойства.
( Ляпис ) основное получение реакцией серебра с азотной кислотой :
Получение нитрата серебра
Основное получение действием азотной кислоты на серебро содержащие материалы или шлам, основывается на окислении серебра сильной азотной кислотой, в результате чего получается нитрат серебра (азотно кислое серебро) оксид азота и вода.
В результате получается технический нитрат, для очищения реагируют с хлоридом натрия, почти чистый хлорид серебра (творожистый осадок) восстанавливают до металлического серебра, получается чистый нитрат серебра.
В производственных масштабах чистый нитрат серебра, получают из уже аффинированного серебра (не менее 99,8 %), реагируя его с азотной кислотой в присутствии кислорода (для доокисления высших в более высокие оксиды азота).
Применение
Для лечения некоторых болезней язв, в акушерстве. Служит источником для получения других веществ в том числе и некоторых органических. В анализе серебра содержащих материалов, в производстве зеркал и зеркальных покрытий.
В недавнем прошлом применялся как компонент проявителя для фотографий, фотоэмульсий, а также для усилителей и других серебро содержащих растворов.
Ионы серебра применяются в косметических средствах, мазях для борьбы с угрями и прыщами.
Свойства нитрата серебра
Теплоёмкость 93,0 Дж/(моль·К). Энтальпия образования −124,5 кДж/моль. Энтропия 140,9 Дж/(моль·К) при 298 К.
Реакции нитрата
Реакция с щелочами приводит к образованию оксида серебра ( I ) и нитрата щёлочи :
Карбонат натрия приводит к образованию карбоната серебра и нитрата серебра :
Реакция с серной кислотой ( конц. ) приводит к образованию сульфата серебра и азотной кислоты :
Взаимодействие сульфата натрия даёт сульфат серебра и нитрат натрия :
Реакция с ортофосфатом натрия даёт ортофосфат серебра и нитрат натрия :
Реакция с соляной кислотой приводит к образованию хлорида серебра :
Реакция с хлором приводит к образованию оксида азота ( V ) кислорода и хлорида серебра реакция протекает в присутствии четырёх хлористого углерода ( катализатор ) при 0°C :
Реакция с сероводородом даёт сульфит серебра и азотную кислоту :
С разбавленной даёт оксид серебра ( I ) и аммиачную селитру :
Подобно себя ведёт тиосульфат натрия в концентрированном состоянии даёт комплексное соединение и нитрат натрия :
В разбавленном состоянии даёт тиосульфат серебра :
Реакция с концентрированными цианидами приводит к комплексному соединению дицианоаргентат( I ) натрия и нитрата натрия :
С разбавленным цианид серебра и нитрат натрия :
С концентрированным роданид (тиоцианат) калия даёт комплексное соединение дицианоаргентумат калия и нитрат калия :
С разбавленным нитрат калия и тиоцианат серебра :
Концентрированный нитрит калия даёт комплексное соединение и нитрат калия :
С разбавленным нитрат калия и нитрит серебра :
Реакция с концентрированным с сульфитом натрия даёт комплексное соединение битиосульфатоаргенат ( I ) натрия и нитрат натрия :
С разбавленным сульфит серебра и нитрат натрия :
Статья на тему нитрат серебра
Похожие страницы:
Понравилась статья поделись ей
Нитрат серебра
Нитра́т серебра́(I) (азотноки́слое серебро́, ля́пис от лат. lapis — камень, «адский камень») — бесцветные ромбические кристаллы. Плотность 4,352 г/см³. Температура плавления 209,7 °C. При температуре выше 300 °C разлагается. Растворимость в воде (г/100 г): 122,2 при 0 °C; 222,5 при 20 °C; 770 при 100 °C. Растворимость в метиловом спирте 3,6 г/100 г; в этиловом спирте 2,12 г/100 г; в ацетоне 0,44 г/100 г; в пиридине 33,6 г/100 г (все растворимости — при 20 °C).
Нитрат серебра может быть синтезирован растворением серебра в азотной кислоте по реакции:
Оставляет на коже тёмные пятна, используется в медицине для прижигания и стерилизации ранок. Применяется также в аналоговой фотографии.
Использование в медицине
Нитрат серебра используется в медицине (ляписный карандаш) для прижигания ранок. Используется как действующие вещество в гомеопатии.
Впервые ляпис применили врачи Ян-Баптист ван Гельмонт (1579—1644) и Франциск де ла Бое Сильвий (1614—1672), которые научились получать нитрат серебра взаимодействием металла с азотной кислотой.
Они обнаружили, что прикосновение к кристаллам полученной серебряной соли приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов. Адский камень, строго говоря, не чистый нитрат серебра, а его сплав с нитратом калия, иногда отлитый в виде палочек — ляписного карандаша. Ляпис оказывает прижигающее действие и применяется с давних пор. Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани. [1]
Ляпис в литературе
В романе И. С. Тургенева ««Отцы и дети» Евгений Базаров просит у своего отца адский камень:
Дня три спустя Базаров вошел к отцу в комнату и спросил, нет ли у него адского камня?
— Есть; на что тебе?
— Нужно. ранку прижечь.
Источники
Также ляписный карандаш используется при лечении вроcшего ногтя.
Нитрат серебра(I)
| Под вечный гул вертящихся колес. Нитрат серебра | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
| Химическая формула | AgNO3 |
| Эмпирическая формула | AgNO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Плотность | 4,352 г/см³ |
| Термические свойства | |
| Температура плавления | 209,7 °C |
| Химические свойства | |
| Растворимость в воде | 122,2 (0 °C); 222,5 (20 °C); 770 (100 °C) г/100 мл |