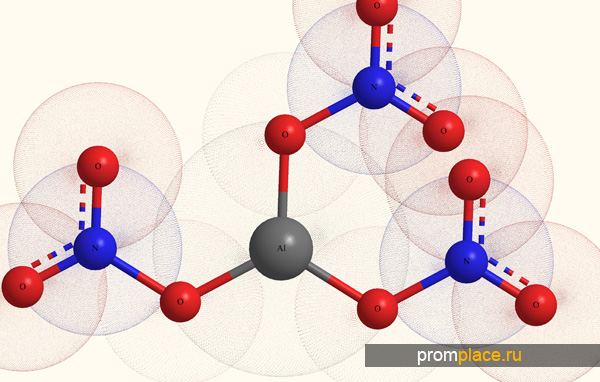
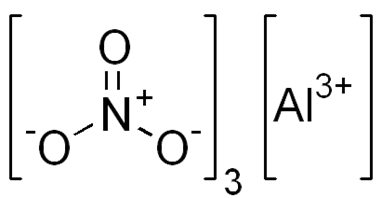Нитрат алюминия что это
Нитрат алюминия: формулы, свойства, применение и риски
Содержание:
В нитрат алюминия Это алюминиевая соль азотной кислоты. Нонагидрат нитрата алюминия при комнатной температуре выглядит как бесцветное твердое вещество с запахом азотной кислоты.
Продолжительное воздействие огня или тепла может привести к взрыву. При контакте с огнем выделяют оксиды азота. Его использование включает переработку нефти, а также крашение и дубление кожи.
Это белая водорастворимая соль, которая чаще всего встречается в кристаллической нонагидратной форме (нонагидрат нитрата алюминия).
Формулы
Состав
В 2D
В 3D
Физические и химические свойства
Оповещения о реактивности
Реакции с воздухом и водой
Нитрат алюминия расплывается (он имеет свойство поглощать влагу из воздуха с образованием водного раствора). Растворим в воде. Его водные растворы кислые.
Воспламеняемость
Особые опасности от продуктов сгорания: при пожаре могут образоваться токсичные оксиды азота, связанные с нитратом алюминия.
Реактивность
Нитраты и нитриты могут действовать как чрезвычайно мощные окислители, а смеси с восстановителями или восстановленными материалами, такими как органические вещества, могут быть взрывоопасными. Они реагируют с кислотами с образованием токсичного диоксида азота.
В целом, нитратные и нитритные соли с окислительно-восстановительными катионами (переходные металлы и металлы групп 3a, 4a и 5a периодической таблицы, а также катион аммония [NH4] +) более реактивны с органическими материалами и агентами. редукторы в условиях окружающей среды.
Токсичность
Люди подвержены токсическому воздействию нитратов и нитритов, а дети особенно уязвимы к метгемоглобинемии.
Проглатывание больших доз нитрата алюминия вызывает раздражение желудка, тошноту, рвоту и диарею. Контакт с пылью раздражает глаза и кожу.
Приложения
Нитраты и нитриты широко используются (и в очень больших количествах) в качестве удобрений в сельском хозяйстве из-за их готовности расщеплять и выделять азот для роста растений, а также из-за их растворимости, которая позволяет нитрат-ионам быть всасывается корнями растения.
Нитратные соединения также широко используются в качестве промышленного сырья, когда требуется окислитель или источник нитрат-иона.
Нитрат алюминия используется в производстве лабораторных, косметических химикатов и средств личной гигиены. В промышленности он используется в качестве промежуточного вещества при производстве других веществ.
Он используется при дублении кожи, в антиперспирантах, ингибиторах коррозии, при добыче урана, нефтепереработке и в качестве нитрующего агента.
Нонагидрат нитрата алюминия и другие гидратированные нитраты алюминия находят множество применений. Эти соли используются для производства глинозема для изготовления изоляционной бумаги, в нагревательных элементах электронно-лучевых трубок и в слоистых материалах сердечников трансформаторов. Гидратированные соли также используются для извлечения актинидных элементов.
Клинические эффекты
Алюминий вездесущ, это самый распространенный металл в земной коре. Большая часть воздействия на человека происходит с пищей. Он присутствует в некоторых фармацевтических продуктах. В промышленности он широко используется.
Алюминий подавляет ремоделирование костей, вызывая остеомаляцию. Считается, что он подавляет эритропоэз, вызывая анемию.
Острое отравление бывает редко. Растворимые формы алюминия обладают большим потенциалом токсичности, чем нерастворимые формы, из-за их большей абсорбции.
Пациенты с почечной недостаточностью предрасположены к токсичности алюминия из-за алюминия в диализате или из других экзогенных источников, особенно фосфатсвязывающих и алюминийсодержащих антацидов.
Хроническое воздействие алюминиевой пыли может вызвать одышку, кашель, фиброз легких, пневмоторакс, пневмокониоз, энцефалопатию, слабость, нарушение координации движений и эпилептиформные припадки.
Соли алюминия могут вызывать раздражение глаз и слизистых оболочек, конъюнктивит, дерматоз и экзему.
Хотя алюминий и его соединения показали мало доказательств канцерогенности для человека, воздействие других веществ, участвующих в производстве алюминия, было связано с канцерогенностью.
Безопасность и риски
Формулировки опасности Согласованной на глобальном уровне системы классификации и маркировки химических веществ (СГС).
Классы опасности (и соответствующие им главы СГС), стандарты классификации и маркировки, а также рекомендации для нитрата алюминия и нонагидрата нитрата алюминия приведены ниже (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
Классы опасности GHS
Коды предупреждений
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405 и P501 (PubChem, 2017).
Ссылки
Схема производства хлеба: этапы и их характеристика
Археоцианаты: классификация, характеристика, среда обитания, виды
Нитрат алюминия
| Нитрат алюминия | |
|---|---|
 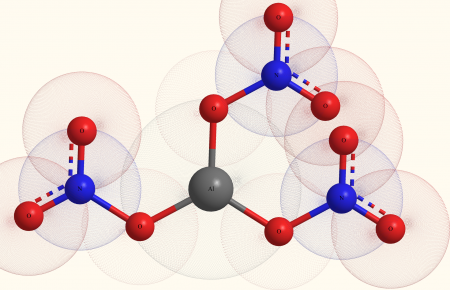 | |
| Систематическое наименование | Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий, нитрат алюминия, тринитрат алюминия, алюминия III нитрат |
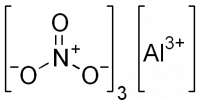
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89 |
| Температура | |
| • плавления | 66 °C (с разл.); нонагидрат: 73,5 |
| Энтальпия | |
| • образования | − 927 кДж/моль; нонагидрат: − 3757; гексагидрат: − 2871 кДж/моль |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9 |
| • в в метаноле | при 35 °C: 14,45 |
| • в в этаноле | при 35 °C: 8,63 |
| • в в этиленгликоле | при 35 °C: 18,32 |
| Кристаллическая структура | моноклинная |
| Рег. номер CAS | 13473-90-0 7784-27-2 (нонагидрат) |
| PubChem | 16713320 |
| Рег. номер EINECS | 236-751-8 |
| SMILES | |
| RTECS | BD1040000 BD1050000 (нонагидрат) |
| ChemSpider | 24267 |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Содержание
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
|---|---|---|---|---|---|---|---|---|
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота V (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота V:
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.
Нитрат алюминия
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
Химические свойства
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
8 A l + 30 H N O 3 = 8 A l ( N O 3 ) 3 + 3 N 2 O ↑ + 15 H 2 O
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
A l ( O H ) 3 + 3 H N O 3 = A l ( N O 3 ) 3 + 3 H 2 O
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
A l 2 ( S O 4 ) 3 + 3 B a ( N O 3 ) 2 = 2 A l ( N O 3 ) 3 + 3 B a S O 4 ↓
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
A l ( N O 3 ) 3 ⋅ 9 H 2 O + 9 N 2 O 5 ⟶ A l ( N O 3 ) 3 + 18 H N O 3 ( 1 )
(1)>>> A l C l 3 + 3 C l N O 3 ⟶ A l ( N O 3 ) 3 + 3 C l 2 ( 2 )
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V):
A l 2 O 3 + 3 N 2 O 5 ⟶ 2 A l ( N O 3 ) 3
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
2 A l B r 3 + 8 N 2 O 5 = 2 [ N O 2 ] − [ A l ( N O 3 ) 4 ] + + 3 B r 2 + 6 N O 2
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Соли металлов очень часто используются для изготовления различных элементов, которые играют важное значение в других отраслях промышленности. Поэтому их довольно часто синтезируют из разнообразных соединений, чтобы затем использовать в своих целях. Нитрат алюминия относится к наиболее востребованным веществам, так как обладает прекрасными свойствами и может быть применен в широких масштабах.
Благодаря высокой химической активности солеобразующих металлов, свойства будут весьма ярко проявляться, так что именно поэтому стараются выбирать активные соединения. С ними проще работать, но могут потребоваться специальные условия хранения, так как в некоторых случаях реакция происходит прямо на открытом воздухе, что недопустимо, так как не будет контроля.
Химическая формула и свойства соединения
Условными обозначениями формула нитрата алюминия выглядит следующим образом:Аl(NО3)3. Это соединение обладает следующими параметрами:
Нитрат алюминия 3 можно получить несколькими способами, которые дают одинаково хороший результат, а отличаются лишь необходимостью наличия разных компонентов:
1. Самым простым способом будет растворение или так называемое травление чистого металла в разведенной азотной кислоте: 8Аl+30НNО3=8Аl(NО3)3+3N2О+15Н2О.
2. Также можно осуществлять воздействие азотной кислотой на основание алюминия: Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
3. Можно проводить реакцию замещения, для чего используются менее активные металлы, которые вытесняются алюминием: Аl2(SО4)3+3BА(NО3)2=2Аl(NО3)3+3BАSО4.
4. Чтобы сразу получить безводный раствор, нужно провести реакцию кристаллогидрата, которая может иметь два вида взаимодействий:
5. В промышленности твердое вещество также получают двумя основными методами:
6. Можно применять в качестве исходного сырья бромид алюминия, тогда реакция будет протекать постепенно в две стадии:
Как видно, раствор нитрата алюминия и твердое вещество можно получить большим количеством способов, причем для этого даже не потребуются специальные условия.
Реакции, в которых может принимать участие вещество
Алюминий относится к категории амфотерных элементов, так что при определенных условиях он может проявлять разные свойства. Это широко используется в промышленности, чтобы можно было управлять химическими реакциями в зависимости от необходимости. Нитрат алюминия взаимодействует с большим количеством соединений различного рода, так что может использоваться в широком спектре работ:
Это только небольшой перечень реакций, в которые вступает вещество.
Использование алюминиевой соли азотной кислоты
Вещество используется на текстильных фабриках для протравки тканей перед покраской, играет важную роль при дублении кожи, служит для изготовления нитей накаливания. Каталитические свойства применяется для очистки нефти от различных вредных примесей, а также может убирать коррозию с металлов и некоторых сплавов. Входит в состав некоторых антиперспирантов.
Опасность вещества для человека находится на низком уровне или отсутствует вовсе. Твердые элементы можно брать в руки без защитных перчаток, а нюхать материал без какого-либо опасения получить ожог дыхательный путей. Случаи попадания алюминиевого нитрата в пищеварительную систему человека не фиксировались, так что сказать об опасности сложно.
При проведении испытаний на крысах после внутреннего употребления погибла половина испытуемой группы. Так что наверняка опасность присутствует, но в любом случае, ни одно химическое вещество нельзя употреблять в пищу, пока его свойства не будут исследованы и не доказана польза для организма.
Формула нитрата алюминия
Определение и формула нитрата алюминия
Хорошо растворяется в воде (гидролизуется по катиону). Растворяется в азотной кислоте. Реагирует со щелочами, гидратом аммиака.
Рис. 1. Нитрат алюминия. Внешний вид.
Химическая формула нитрата алюминия
Химическая формула нитрата алюминия Al(NO3)3. Она показывает, что в состав данной молекулы входят один атом алюминия (Ar = 27 а.е.м.), три атома азота (Ar = 14 а.е.м.) и девять атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата алюминия:
Mr(Al(NO3)3) = 27 + 3×14 + 9×16 = 27 + 42 + 144 = 213.
Графическая (структурная) формула нитрата алюминия
Структурная (графическая) формула нитрата алюминия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Ионная формула
Нитрат алюминия представляет собой электролит, который диссоциирует на ионы в водном растворе согласно следующему уравнению реакции:
Примеры решения задач
| Задание | При нейтрализации 25,5 г предельной одноосновной кислоты избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. |
| Решение | Запишем уравнение реакции нейтрализации предельной одноосновной кислоты избытком раствора гидрокарбоната натрия в общем виде: |
Рассчитаем количество вещества выделившегося в ходе реакции углекислого газа:
n(CO2) = 5,6 / 22,4 = 0,25 моль.
Рассчитаем молярную массу предельной одноосновной кислоты:
Определим число атомов углерода в молекуле предельной одноосновной кислоты (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода, 1 – для водорода и 16 для кислорода):
M(CnH2n+1COOH) = 12n + 2n + 1 + 12 + 16 + 16 +1 = 14n + 46;
14n + 46 = 102 г/моль;
Значит молекулярная формула предельной одноосновной кислоты C4H9COOH.
| Задание | Установите молекулярную формулу алкена, если известно, что 2,8 г его способны присоединить 1120 мл (н.у.) хлороводорода. |
| Решение | Запишем уравнение реакции присоединения хлороводорода к алкену в общем виде: |
Рассчитаем количество вещества хлороводорода:
n(HCl) = 1,2 / 22,4 = 0,05 моль.
Согласно уравнению реакции n(HCl): n(CnH2n) = 1:1, т.е. n(CnH2n) = n(HCl) = 0,05 моль.
Рассчитаем молярную массу алкена:
Определим число атомов углерода в молекуле алкена (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода и 1 – для водорода):
Значит молекулярная формула алкена C4H8.