Нейтрофильное воспаление у кошек чем лечить
Ликвор. Плеоцитоз
Неврологическое отделение для больных с нарушением мозгового кровообращения
При исследовании биологических жидкостей, и СМЖ в том числе, обычно подсчитывают число клеток и цитограмму в мазках, окрашенных азурэозином (по Романовскому-Гимза, Нохту, Паппенгейму). Подсчет клеточных элементов в ликворе (определение цитоза) производят с помощью камеры Фукс-Розенталя, предварительно разводя его реактивом Самсона в 10 раз. Использование именно данного красителя, а не какого-либо иного, позволяет окрашивать клетки в течение 15 мин и сохранять клетки неизмененными до 2 часов.
Количество клеток во всей камере делят на 3, так получают цитоз в 1 мкл. Для большей точности считают цитоз в трех камерах. При отсутствии камеры Фукс-Розенталя можно воспользоваться камерой Горяева, подсчитав клетки по всей сетке также в трех камерах, результат умножают на 0.4. До сих пор встречаются разночтения в единицах измерения цитоза – количество клеток в камере, в 1 мкл или 1 л. Вероятно, целесообразно все же выражать цитоз количеством клеток в мкл. Для подсчета числа лейкоцитов и эритроцитов в СМЖ могут быть использованы и автоматизированные системы.
Увеличение содержания клеток в СМЖ (плеоцитоз) появляется чаще при воспалительных заболеваниях, в меньшей степени – при раздражении мозговых оболочек. Наиболее выраженный плеоцитоз отмечается при бактериальной инфекции, грибковых поражениях мозга и туберкулезном менингите. При эпилепсии, арахноидите, гидроцефалии, дистрофических процессах и некоторых других заболеваниях ЦНС цитоз остается нормальным.
Окрашивание клеток нативного препарата реактивом Самсона позволяет достаточно достоверно дифференцировать клетки. Но более точная их морфологическая характеристика достигается после фиксации и окраски приготовленных цитологических препаратов. Современный подход к подготовке таких препаратов предполагает использование цитоцентрифуги. Однако, даже в США ими оснащены только 55% лабораторий (Rabinovitch A et al., 1994). Поэтому на практике используется более простой способ – осаждение клеток на предметное стекло. Препараты должны быть хорошо высушены на воздухе, а потом окрашены.
Клинические аспекты.
Морфология всех этих клеточных элементов обычно хорошо известна врачам лабораторной диагностики и детально описана во многих руководствах. Уровень плеоцитоза и характер цитограммы ликвора позволяют уточнить характер патологического процесса (табл.).
Количество клеток в ликворе при различных заболеваниях
Число клеток в 1 мкл
Заболевания
Острый бактериальный менингит, прорыв абсцесса головного мозга
Нейтрофильное воспаление у кошек чем лечить
Несмотря на то, что большинство кошачьих инфекционных заболеваний затрагивают только кошек, некоторые из этих заболеваний могут передаваться от кошек людям. Рассмотрим наиболее распространенные заболевания, переносчиками которых являются кошки. В данном материале можно будет ознакомиться с простыми мерами профилактики, соблюдая которые, мы можем снизить риск инфицирования.
Каковы риски?
Люди с незрелой или ослабленной иммунной системой более восприимчивы к этим заболеваниям.
В группу риска входят:
Бактериальные инфекции
Болезнь кошачьих царапин
Пастереллез
Чаще всего пастереллез возникает после укусов, оцарапывания кошками. Клинически формы заболевания можно разделить на 3 группы:
Сальмонеллез
Сальмонелла чаще встречается у кошек, которые питаются сырым мясом или дикими птицами и животными. Инфицирование человека может произойти в процессе уборки кошачьего туалета. Возбудитель выделяется с фекалиями инфицированных кошек. Среди симптомов у человека чаще всего отмечается диарея, лихорадка и боли в желудке.
Паразитарные инфекции
Блохи являются наиболее распространенным внешним паразитом кошек, их укусы могут вызывать зуд и воспалительные реакции у людей и кошек. Блохи являются переносчиками яиц ленточных червей. Во время выкусывания и проглатывания блох, яйца гельминтов попадают в пищеварительный тракт и далее в кишечник кошки, где начинается размножение паразитов.
Токсокароз (toxocariasis), характеризуется лихорадкой, бронхитом, пневмонией, увеличением печени, селезенки, эозинофилией.
Анкилостомоз, или земляная чесотка – гельминтоз, протекающий с аллергическими поражениями кожи, органов дыхания (на ранней стадии), ЖКТ и железодефицитной анемией (на поздней стадии).
Грибковые инфекции
Стригущий лишай
У людей стригущий лишай часто проявляется в виде круглых, красных, зудящих поражений с кольцом по краям. Повреждения могут локализоваться в самых разных местах, включая волосяной покров головы, ноги, паховую область или подбородок. Стригущий лишай передается при контакте с кожей или шерстью зараженного животного, либо непосредственно, либо из зараженной среды. Заражённые кошки непрерывно выделяют споры грибов на коже и шерсти. Эти споры, способны вызывать инфекцию в течение многих месяцев.
Протозойные инфекции
Источник инфекции – одноклеточные организмы.
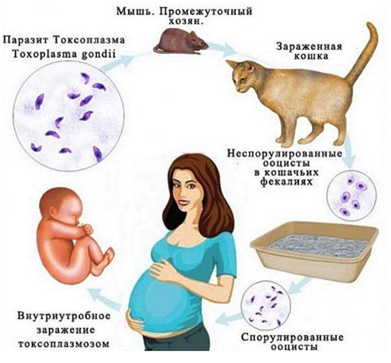
Токсоплазмоз
Кошки могут передавать токсоплазму человеку через фекалии (во время уборки кошачьего туалета). Симптомы токсоплазмоза включают гриппоподобные боли в мышцах и лихорадку, а также головную боль. В редких случаях могут наблюдаться более сложные симптомы, такие как судороги, рвота или диарея.
Криптоспоридиоз — кишечная инфекция, вызываемая простейшими и, характеризующаяся развитием водянистого поноса и лихорадки. Болеют в основном дети.
Лямблиоз
Основные проявления лямблиоза – это аллергические и патологические неврологические реакции.
Вирусные инфекции
Меры предосторожности:
В случае если произошло оцарапывание, ослюнение, немедленно промойте рану под проточной водой. Если в месте укуса, оцарапывания появились признаки воспаления, нагноения, увеличение и болезненность лимфатических узлов – обратитесь за медицинской помощью.
Различия в общем анализе крови при вирусной и бактериальной инфекции
ОАК при вирусной инфекции:
ОАК при бактериальной инфекции:
⠀
ОАК надо сдавать натощак, потому что после приема пищи возможен физиологический пищевой лейкоцитоз. В этом случае могут быть сложности с интерпретацией результата.
⠀
При наличии симптомов ОРВИ изменения в общем анализе крови лучше смотреть на 2-3 сутки.
⠀
Для дифдиагностики вирусной и бактериальной инфекций можно смотреть значение С-реактивного белка. Бактериальная инфекция сопровождается высоким уровнем СРБ уже в первые 24 часа от начала заболевания, а вирусная инфекция сопровождается лишь незначительным повышением.
* Цены и сроки готовности результатов анализов, указанные на сайте, носят информативный характер, являются актуальными на текущее время и могут быть изменены на дату оплаты. Ценовое предложение не является публичной офертой. Всю информацию необходимо уточнять у администратора.
Персональные, в том числе биометрические, данные сотрудников ООО «УГМК-Здоровье» размещены на официальном сайте (www.ugmk-clinic.ru) в целях исполнения п. 7 ч. 1 ст. 79 Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» с письменного согласия сотрудников.

Мы используем файлы cookie, для наиболее эффективной работы сайта. Продолжая просматривать страницу, вы соглашаетесь с использованием cookie.
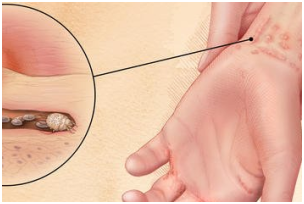
Насколько опасен фелиноз: болезнь кошачьих царапин
Болезнь кошачьих царапин (фелиноз), имеет второе название – лихорадка от кошачьих царапин или бартонеллез. Вызывается заболевание бактериальной инфекцией, попадающей к человеку при оцарапывании кошкой.
Существует минимум 8 видов Bartonella, вызывающих заболевания человека, в то время как Bartonella henselae – это наиболее распространенный вид инфекции, встречающийся у кошек. Болезнь кошачьих царапин может поражать людей, собак, кошек и других животных. Свое название болезнь получила, так как часто ассоциируется с кошачьей царапиной.
Передача бактерий фактически происходит через кошачьих блох и, возможно, других кусающих мух или клещей. Блоха проглатывает кровь зараженной кошки, содержащую бартонеллу, бактерии размножаются в блохах и выделяются с фекалиями. При попадании частиц под ногти кошки, животные могут заразить людей через царапины или ссадины на коже, а также через глаза (при облизывании).
Каковы признаки болезни кошачьих царапин?
Типичными признаками инфекции являются умеренная температура, озноб и недомогание, повышенная утомляемость, сопровождающиеся увеличением лимфатических узлов и поражениями на коже или конъюнктиве (оболочке, покрывающей белок глаза и внутреннюю часть века). Большинство симптомов длятся несколько дней, но увеличенные лимфатические узлы могут сохраняться в течение недель или месяцев.
В этих случаях может развиться более тяжелое заболевание с любой комбинацией следующих признаков:
Эти более серьезные формы заболевания часто связаны с основным иммунодефицитом, например, с инфекцией ВИЧ / СПИДа или химиотерапией. Однако, в настоящее время, врачи не до конца понимают, почему некоторые люди заболевают более серьезной формой бартонеллеза.
Откуда возник бартонеллез человека?
До 1990 г. было только два известных патогенных или болезнетворных вида Bartonella: B. quintana (возбудитель траншейной лихорадки во время Первой мировой войны) и B. bacilliformis (возбудитель лихорадки Оройя в Перу и других странах Южной Америки). Было известно, что эти две болезни поражают людей, но еще не были признаны болезнью домашних, передаваемых людям. С 1990 г. было идентифицировано более 24 видов Bartonella; по крайней мере, половина из них были причастны или подтверждены как патогены животных или человека.
Начиная с начала 1990-х годов, организмы Bartonella стали объектом значительных научных и медицинских исследований. Ветеринарные работники здравоохранения считаются дозорной группой по бартонеллезу человека. Это означает, что они считаются первыми, у которых болезнь может проявиться и, соответственно, будет наиболее распространенной. Несколько исследований изучают распространенность болезни в этой группе.
Насколько распространена болезнь кошачьих царапин?
Невозможно дать точные оценки распространенности фелиноза, потому что не все случаи диагностированы или зарегистрированы. Однако считается, что это достаточно распространенная болезнь. Исследования показывают, что около 5% населения были подвержены инфекции, но лишь небольшой процент этих людей сообщил о наличии этого заболевания.
Вероятно, что многие инфекции, вызванные бартонеллами человека, проходят незамеченными без симптомов и представляют собой не более чем легкую простуду.
После заражения у большинства людей вырабатывается иммунитет против бартонеллы. Котята более подвержены заражению, чем взрослые кошки, и передают бактерии людям.
Эксперты считают, что около 40% кошек в какой-то момент своей жизни являются носителями B. henselae. Кошки, являющиеся носителями B. henselae, не проявляют никаких признаков болезни; следовательно, вы не можете сказать, какие кошки могут распространять болезнь.
Термин «болезнь кошачьих царапин» неправильно обозначает, что кошки являются единственным источником передачи и инфекции. Хотя, во многих случаях, фелиноз возникает после кошачьей царапины, и кошки являются основным резервуаром B. henselae и других видов Bartonella, которые могут вызывать заболевания человека. Некоторые люди, инфицированные Bartonella, не имеют в анамнезе кошачьих царапин или укусов, а у других не было известных контактов с кошками. У этих людей передача из источников окружающей среды осуществлялась различными кусающими насекомыми (блохи и клещи) или другими животными-хозяевами бартонелл.
Кошки заражаются через укусы блох. Когда блоха питается кровью инфицированной кошки, которая может нести чрезвычайно большое количество циркулирующих B. henselae в своей крови, она проглатывает микроорганизмы. Некоторые из микробов, как предполагается, могут проникнуть в человека, если блоха укусит человека. Тем не менее, пока нет доказательств того, что укус зараженной блохи может вызвать у кого-то фелиноз. Скорее, инфекция возникает в результате контакта с экскрементами блох, инфицированными B. henselae (грязь от блох под ногтями кошки).
Кошки остаются заразными в течение нескольких недель, после чего организм исчезает из крови. Неясно, можно ли заразить кошек повторно. Нет зарегистрированных случаев заражения кого-либо более одного раза. Еще многое предстоит узнать о фактической передаче болезни и процессе распространения болезни кошачьих царапин. Что мы действительно знаем, так это то, что борьба с блохами и их профилактика являются ключом к предотвращению фелиноза у людей.
Есть ли вакцина или лечение от болезни кошачьих царапин?
В настоящее время нет вакцины от фелиноза для кошек или людей. B. henselae чувствителен к ряду антибиотиков. Для лечения инфицированных людей чаще всего назначают комбинацию двух разных типов антибиотиков. Заболевание обычно проходит само по себе, и большинство легких случаев проходят без приема антибиотиков.
Есть ли тест на болезнь кошачьих царапин?
Доступны тесты, особенно для людей, которые, как считается, заразились бартонеллезом. Если у вашей кошки есть признаки болезни, можно провести несколько анализов для диагностики этого заболевания, в том числе тестирование на антитела для выявления контакта с бактериями, тестирование ДНК (ПЦР) для выявления бактерий в крови вашей кошки и посев крови для выращивания любых бактерий, которые могут быть в кровотоке вашей кошки.
Поможет ли удаление когтей моей кошки снизить риск распространения болезни кошачьих царапин?
Нет доказательств того, что удаление когтей кошек снижает риск передачи B. henselae людям! Рекомендуется уберечь кошку от блох и избегать или предотвращать ситуации, которые могут привести к укусам и царапинам. Помните, В.henselae передается человеку при контакте с зараженной блохой и грязью.
Контакт возможен разными способами:
Какие шаги я могу предпринять, чтобы снизить риск фелиноза?
Вагиниты, вызванные условно-патогенной микрофлорой: рекомендации для практикующих врачей
Сведения об авторе:
Пустотина Ольга Анатольевна, доктор медицинских наук, профессор кафедры акушерства, гинекологии и репродуктивной медицины ФПК МР РУДН Адрес: 117198 Москва, ул. Миклухо-Маклая д. 6, телефон 8 (495) 787-38-27, email: rudn@rudn.ru Pustotina Olga Anatolievna, Doctor of Medicine, Professor of The department of Obstetrics, Gynecology and Reproductive Health, Peoples’ Friendship University of Russia. Address: 117198 Moscow, Mikluho-Maklaya str, 6. Phone 8(495)7873827
Нормальная микрофлора женских половых органов
Таким образом, во влагалище здоровых женщин репродуктивного возраста общая численность бактерий составляет 105-106 КОЕ/мл выделений, 95% которых представлены лактобактериями и только 5% формируется представителями других видов аэробных и анаэробных УПМ.
Вагиниты, вызванные УПМ
Вагиниты бывают воспалительного и невоспалительного характера. Воспалительные вагиниты в зависимости от вида возбудителя разделяют на неспецифические и специфические. К специфическим относятся трихомонадный, хламидийный, гонококковый и грибковый вагинит (вагинальный кандидоз), при обнаружении любых других УПМ вагинит является неспецифическим. Невоспалительный вагинит называется бактериальным вагинозом. Бактериальный ваги- ноз, неспецифический вагинит и вагинальный кандидоз объединяют вагиниты, вызванные УПМ.
Бактериальный вагиноз не относится к инфекциям, передаваемым половым путем (ИППП), но связан с сексуальной активностью женщины и может вызывать симптомы уретрита у мужчин. Происходящие во влагалищном биотопе изменения облегчают восходящее инфицирование ИППП: гонококками, хламидиями, трихо- монадами, ВИЧ-инфекцией и др. Кроме того, накапливаясь в большом количестве, УПМ проникают в полость матки, вызывая хроническую воспалительную реакцию, приводя к бесплодию, невынашиванию беременности и снижению эффективности программ ЭКО [7, 8].
Вагинальный кандидоз-это воспаление слизистой оболочки влагалища, вызванное дрожжевыми грибами рода СапсНс1а, которое встречается у 5-10% женщин репродуктивного периода. Развитие кандидоза в основном расценивают как вторичную эндогенную инфекцию, резервуаром которой является желудочно-кишечный тракт. Основными причинами, способствующими проникновению грибов из аногенитальной области во влагалище и их интенсивному размножению, является прием антибиотиков, глюкокортикоидов, потребление пищи с большим количеством углеводов. Предрасполагающими к заболеванию факторами служат ожирение, сахарный диабет и нарушение правил личной гигиены 11.
Факторы риска вагинитов, вызванных УПМ
Устойчивость экосистемы влагалища определяется факторами эндогенного и экзогенного происхождения. К развитию дисбиотических процессов в вагинальном микроценозе наиболее часто приводят: стресс, лечение антибиотиками, гормональная терапия, эндокринные и аллергические заболевания, снижение иммунной защиты организма, хронические запоры, инфекция мочевых путей. Уменьшение доли лактобацилл и повышение рН в содержимом влагалища происходит при повреждениях эпителиального покрова в результате полового акта, трещин, расчесов, при чрезмерной гигиене наружных половых органов. Нередко женщины при появлении неприятного запаха из половых путей прибегают к спринцеванию. Спринцевание не имеет ни гигиенического, ни профилактического, ни лечебного эффекта, а усугубляет дис- биоз и является фактором риска воспалительных заболеваний органов малого таза. Нарушение экосистемы влагалища может возникать после полового акта вследствие действия спермы с высоким уровнем рН, при частой смене половых партнеров, во время аногенитальных контактов, при использовании некоторых спермицидов. Длительное маточное кровотечение, инородные тела во влагалище (тампоны, пессарии, швы при истмико-цервикальной недостаточности) нередко также сопровождаются патологическими выделениями из половых путей [4, 6, 7, 9].
Клиника и диагностика вагинитов, вызванных УПМ
В основе вагинитов, вызванных УПМ, лежит уменьшение колоний лактобактерий, в результате которого изменяется рН вагинальной среды с кислой на щелочную и создаются условия для разрастания УПМ и их адгезии на освобождающийся эпителий слизистой оболочки влагалища.
Все происходящие изменения вагинального биотопа объединяются диагностическими критериями Амселя: появление специфических белей из половых путей, увеличение рН вагинального отделяемого, «рыбный» запах и наличие «ключевых клеток», представляющих собой эпителиальные клетки, порытые сплошным слоем различных микроорганизмов. По последним данным, даже наличие двух критериев из четырех позволяет установить нарушение вагинального микробиоценоза [5].
Кроме того, возбудители ИППП, такие как хламидии, трихомонады, гонококк и Мусор1а5та депйаПит, также могут колонизировать генитальный тракт, не нарушая нормальный рост лактобактерий и не изменяя рН влагалищного содержимого, в следствие чего до 90% случаев инфицирования ИППП протекают бессимптомно. Поэтому международные и отечественные эксперты 13 рекомендуют дополнительно к микроскопическому исследованию, обладающему низкими диагностическими возможностями в отношении облигатных патогенов, использовать метод полимеразной цепной реакции (ПЦР) для выявления антигенов хламидий, трихо- монад, гонококка и Мусор1а5та депИаИит в отделяемом половых путей.
Таким образом, окончательный диагноз вагинитов, вызванных УПМ, устанавливается при наличии у женщины жалоб на патологические вагинальных выделения и данных микроскопического исследования, и только после исключения ИППП методом ПЦР.
Лечение вагинитов, вызванных УПМ
Первый этап: Противомикробная терапия.
Препаратами выбора для лечения бактериального вагиноза являются производные нитроимидазола и линкозамиды, которые наиболее активно подавляют размножение анаэробной микрофлоры:
Исследования показали, что ни у одной из схем нет преимуществ в эффективности терапии [7], однако при местном использовании значительно реже возникают побочные эффекты [16].
Для лечения неспецифического вагинита рекомендуется использовать клин- дамицин (300 мг 2 р/сут 7 дней, вагинальный крем 2% 5г 7 дней, свечи 100 мг вагинально 3 дня). В сравнении с производными нитроимидазола (метронидазол, тинидазол, орнидазол), он имеет более широкий спектр действия, включающий не только анаэробные, но и аэробные грамположительные и грамотрицательные бактерии [3, 12, 13, 17, 18].
В последние годы опубликованы результаты крупных рандомизированных контролируемых исследований, показавших высокую эффективность лечения нарушений вагинального микробиоценоза еще двумя антибиотиками широкого спектра действия: рифаксимина (250 мг вагинально 5 сут) [19] и нифуратела (250 мг вагинально 10 сут) [20].
Следует отметить, что все выше представленные антибактериальные средства, обладая выраженной подавляющей активностью в отношении УПМ, не влияют на жизнедеятельность полезных молочно-кислых бактерий [15, 19, 20].
Терапия вагинального кандидоза проводится антимикотиками, среди которых препаратами первой линии являются азолы для интравагинального применения (имидазолы):
и азолы для приема внутрь (триазолы):
При остром неосложненном вагинальном кандидозе, вызванном СапсМс1а а1Ысап5, все препараты местного и системного действия одинаково эффективны.
В случаях рецидивирования процесса длительность и количество курсов увеличивается, при этом необходимо идентифицировать вид кандидозной инфекции и исключить возможные факторы риска [10,12-14].
Антисептики:
В настоящее время получено множество доказательств эффективности терапии вагинитов, вызванных УПМ, различными антисептическими средствами, такими как:
Все антисептики обладают широким неспецифическим спектром действия и подавляют рост аэробных и анаэробных микроорганизмов, а также грибов рода СапсМс1а, при этом не влияя на жизнедеятельность колонии лактобактерий [15].
Наибольшая доказательная база (уровень доказательности 1А) продемонстрирована для деквалиния хлорида (флуомизина). В крупномасштабных многоцентровых рандомизированных зарубежных [21 ] и отечественных исследованиях (БИОС-1/М) [18, 22, 24] с участием 321 и 640 пациенток, соответственно, деквалиния хлорид показал сопоставимую эффективность с действием клиндамицина при лечении вагинитов, вызванный УПМ, при значительно лучшей переносимости и меньшей частоте развития кандидоза. Кроме того, вагинальные таблетки деквалиния хлорида обладают хорошей всасываемостью и меньшей текучестью в сравнении с хлоргексидином, поэтому назначаются один раз в сутки, не вызывая аллергических и других побочных эффектов, характерных для повидон-йода, при этом более эффективно уменьшая количество «ключевых клеток» и ПЯЛ в вагинальном мазке [18, 22].
Второй этап: восстановление микробиоценоза
Одной из причин хронизации процесса являются бактериальные пленки, формирующие невосприимчивость микроорганизмов к действию антибактериальных и антисептических средств [23]. В результате уровень излеченности через 3 мес составляет 60-70% и еще ниже через 6 мес [6]. Значительное повышение эффективности терапии вагинитов происходит после проведения второго этапа, направленного на восстановление нормального микробиоценоза [22, 23, 25].
Наилучшие результаты продемонстрировало применение пробиотиков, содержащих живые лактобактерии. Они не только подавляют рост УПМ, ассоциированных с бактериальным вагинозом и неспецифическим вагинитом, за счет образования молочной кислоты, перекиси водорода и бактериоцинов, но и способны разрушать образованные ими биопленки, а также модулируют иммунный ответ и способствуют размножению колоний эндогенных лактобактерий [4, 12, 19, 24, 26, 27].
В качестве дополнительного фактора, улучшающего состояние вагинального микробиоценоза после антимикробной терапии, является применение вагинальных таблеток аскорбиновой кислоты. [28]. В то же время, применение исключительно пробиотиков и/или закисления вагинальной среды без предшествующей антимикробной терапии для лечения вагинитов, вызванных УПМ, недостаточно [7].
Лечение вагинитов, вызванных УПМ, у беременных
Нарушение вагинального микробиоценоза у беременных достоверно сопряжено с повышенным риском преждевременных родов, восходящего инфицирования плода и послеродовых гнойно-септических осложнений [1,8, 29-31 ].
Согласно зарубежным рекомендациям [12, 13] терапия бактериального вагино- за и неспецифического вагинита у беременных женщин не отличается от таковой у небеременных. Препаратом первой линии считается метронидазол для системного и местного применения. При осложненном течении беременности и высоком риске преждевременных родов более эффективным считается назначение клиндамицина, обладающего более широким спектром активности 32. При этом терапию нарушений биоценоза влагалища необходимо проводить с самых ранних сроков беременности [36].
В отечественных рекомендациях [14] антибиотики из группы нитроимидазола и линкозамидов противопоказаны в первом триместре, их применение возможно только местно после 12 нед беременности. Поэтому препаратами выбора для беременных являются вагинальные антисептики широкого спектра действия. Среди антисептических средств только у деквалиния хлорида безопасность применения на любом сроке беременности и в период грудного вскармливания подтверждена в масштабных многоцентровых исследованиях [18, 21, 22, 24]. Беременным с вагинальным кандидозом показано местное применение азолов (клотримазол, миконазол, терканозол и др.) 13. В случаях неэффективности терапии предусмотрено интравагинальное назначение полиенов (натамицин, нистатин) 15. В дальнейшем для профилактики рецидивов вагинальных выделений беременным назначаются пробиотики и средства, подкисляющие вагинальную среду [28, 36].
В заключение хочется отметить, что вагинальный микробиоценоз напрямую связан с состоянием здоровья женщины. Любые нарушения гомеостаза могут сопровождаться патологическими выделениями из половых путей, которые нередко бывают кратковременными, и после нормализации общего состояния самостоятельно проходят. В случаях рецидивирования процесса основной задачей врача является не поиск и идентификация возможных возбудителей, которых при вагинитах, вызванных УПМ, как правило множество, а выяснение причин, приведших к длительному течению заболевания. Для постановки правильного диагноза достаточно простой микроскопии вагинального мазка и метода ПЦР для исключения строгих патогенов. При рецидивирующих патологических вагинальных выделениях необходим также тщательный сбор анамнеза для выявления всех возможных факторов риска, только после устранения которых достигается полноценное восстановление вагинального микробиоценоза.
Список использованной литературы
1. Гуртовой Б.Л., Кулаков В.И., Воропаева С.Д. Применение антибиотиков в акушерстве и гинекологии. – М.: Триада-Х, 2004. – 176с.
2. Sweet RL, Gibbs RS. Infectious diseases of the female genital tract. – 5th ed. Lippincott Williams Wilkins, 2009. 469p.
4. Радзинский В.Е. Бактериальный вагиноз. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Издат журнала StatusPraesens, 2014. – С.249-280.
5. Mittal V, Jain A, Pradeep Y. Development of modified diagnostic criteria for bacterial vaginosis at peripheral health centres in developing countries/ J Infect Dev Ctries. 2012; 6(5): 373-377.
6. Verstraelen H, Verhelst R. Bacterial vaginosis: an update on diagnosis and treatment/ Expert Rev Anti Infect Ther. 2009;7:1109–1124.
7. Donders GG, Zodzika J, Rezeberga D. Treatment of bacterial vaginosis: what we have and what we miss/ Expert Opin Pharmacother. 2014;15(5): 645-657.
8. Leitich H, Bodner-Adler B, Brunbauer M. et al. Bacterial vaginosis as a risk factor for preterm delivery: a meta-analysis/ Am J Obstet Gynecol. 2003;189: 139–147.
9. Filler SG. Insights from human studies into the host defense against candidiasis/ Cytokine. 2012; 58(1): 129-132.
10. Байрамова Г.Р. Рецидивирующий вульвовагинальный кандидоз: автореф. дис. докт.мед.наук.– М., 2013.
11. Роговская С.И., Липова Е.В., Яковлева А.Б. Вульвовагинальные микозы. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Изд-во журнала StatusPraesens, 2014. – С.281-308.
12. CDC. Sexually Transmitted Diseases Treatment Guidelines 2010. http://www.cdc.gov/std/treatment/2010/pid.htm
13. Sherrard J, Donders G, White D. European (IUSTI/WHO) Guideline on the management of vaginal discharge in women reproductive age. 2011.
14. Клинические рекомендации РОАГ. Акушерство и гинекология. – 4-е изд./ под ред. В.Н. Серова, Г.Т. Сухих. – М.: ГЭОТАР-Медиа, 2014. – 1024с.
15. Профилактика, диагностика и лечение инфекций, передаваемых половым путем: рук-во для дерматовенерологов, акушеров-гинекологов, урологов и семейных врачей. – М.:Институт здоровья семьи, 2008.
16. Mikamo H, Kawazoe K, Izumi K, et al. Comparative study on vaginal or oral treatment of bacterial vaginosis / Chemotherapy. 1997; 43:60-68.
17. Практическое руководство по антиинфекционной химиотерапии// Под ред. Л.С. Страчунского, Ю.А. Белоусова, С.Н. Козлова. – М., 2007. – 462с.
18. Подзолкова Н.М., Никитина Т.И. Сравнительная оценка различных схем лечения больных с бактериальным вагинозом и неспецифическим вульвовагинитом // Рос вестник акуш гинекол, 2012.- №4. – С.75-81.
19. Donders GG, Guaschino S, Peters K, et al. A multicenter, double-blind, randomized, placebocontroled study of rifaximin for the treatment of bacterial vaginosis/ Int J Gynaecol Obstet. 2013; 120:131-136.
21. Weissenbacher ER, Donders G, Unzeitig V. et al. Fluomizin Study Group. A comparison of dequalinium chloride vaginal tablets (Fluomizin®) and clindamycin vaginal cream in the treatment of bacterial vaginosis: a single-blind, randomized clinical trial of efficacy and safety. Gynecol Obstet Invest.
2012; 73: 8–15.
23. Swidsinski A, Verstraelen H, Loening-Baucke V. et al. Presence of a polymicrobial endometrial biofilm in patients with bacterial vaginosis/ PLoS One. 2013;8:e53997.
25. McMillan A, et al. Disruption of urogenital biofilms by lactobacilli / Colloids Surf B Biointerfase,2011; 86(1): 58-64.
26. Larsson PG, Stray-Pedersen B, Ryttig KR, Larsen S. Human lactobacilli as supplementation of clindamycin to patients with bacterial vaginosis reduce the recurrence rate; a 6-month, double-blind, randomized, placebo-controlled study./ BMC Women Health, 2008;15(8):3.
27. Ya W, Reifer C, Miller L E. Efficacy of vaginal probiotic capsules for recurrent bacterial vaginosis: a double blind, randomized, placebo-controlled study. Am J Obstet Gynecol. 2010; 203:1200–1208.
28. Zodzika J, Rezerberga D, Donders G. et al. Impact of vaginal ascorbic acid on abnormal vaginal microflora / Arch Gynecol Obstet 2013; 288: 1039-1044.
29. Bothuyne-Queste E, et al. Is the bacterial vaginosis risk factor of prematurity? Study of a cohort of 1336 patients in the hospital of Arras/ J Gynecol Obstet Biol Reprod. 2012; 41(3): 262-270.
30. Pustotina OA, Bubnova NI, Yezhova LS. Pathogenesis of hydramnios and oligohydramnios in placental infection and neonatal prognosis /J mat-fetal&neonat med. 2008; 21(1): 267-271.
31. Pustotina OA. Urogenital infection in pregnant women: clinical signs and outcome /J Perinat Med, 2013; 41:135.
32. Simcox R, Sin WT, Seed PT, et al. Prophylactic antibiotics for the prevention of preterm birth in women at rick: a meta-analysis/ Aust N-Z J Obstet Gynaecol. 2007; 47: 368-377.
33. McDonald HM, Brocklehurst P, Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy/Cochr Database Syst Rev. 2007. N1.P.CD000262.
34. Lamont RF, Duncan SLB, Mandal D, et al. Intravaginal clindamycin to reduce preterm birth in women with abnormal genital tract flora/ Obstet Gynecol. 2003;101:516–522.