Нейроваскулярный синдром нижних конечностей что это
Вертеброгенные нейроваскулярные синдромы
… вертеброгенный фактор предполагает сложные механизмы воздействия на нервные, сосудистые и другие структуры.
В понятие «вертеброгенные нейроваскулярные синдромы» включены разнообразные симптомокомплексы с сочетанным поражением нервной и сосудистой систем, патогенетически связанные с различными факторами: остеохондрозом позвоночника, аномалиями развития позвоночника и ребер, травмами, спаечными процессами, первичными (регионарными) и вторичными (рефлекторными) поражениями мышц.
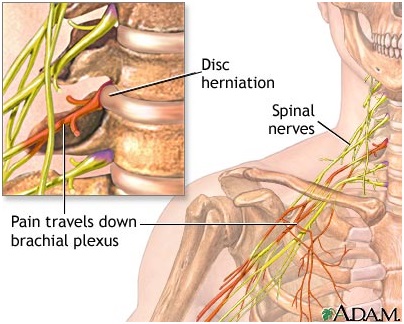
Вертеброгенный фактор предполагает сложные механизмы воздействия на нервные, сосудистые и другие структуры. Наряду с элементами дегенеративно-дистрофической патологии (пролапсы и протрузии диска, остеофиты, сужение межпозвонкового отверстия и др.) большую роль играют местные аутоиммунные механизмы, вызывающие спаечный процесс, которые также сдавливают нервные корешки и сосуды. Основой является компрессия аксонов периферических нервов на различных уровнях.
Среди всех нейроваскулярных синдромов можно выделить симптомокомплексы с наиболее выраженными вегетативно-сосудистыми и трофическими нарушениями. На решающую роль в их происхождении дегенеративно-дистрофического процесса, в частности, в шейном отделе позвоночника указывают начало заболевания с шейных прострелов, возникновение их после неловких движений и поднятия тяжестей, частое сочетание с синдромами передней лестничной мышцы и позвоночной артерии, шейные «болевые феномены», ограничение подвижности шеи, типичные рентгенологические изменения позвоночника.
Этиология и патогенез нейроваскулярных синдромов
В происхождении нейроваскулярных нарушений ведущее значение имеет вертеброгенный фактор, причем роль его неоднозначна: механизмы этих расстройств могут быть компрессионными (непосредственное сдавление нервных структур и сосудистых образований грыжей, остеофитами, гипертрофированными связками, патологически измененными мышцами) и рефлекторными. Рефлекторные механизмы касаются как напряжения некоторых мышц, так и патологических сосудистых реакций. Имеет значение также раздражение периваскулярных симпатических образований. Нельзя исключить и патогенетическую роль моторно-висцеральных рефлексов. Спастическое состояние сосудов поддерживается патологической импульсацией (болевой, проприоцептивной) из тканей пораженного позвоночника и спинальных ганглиев.
Развитие компрессионных нейроваскулярных синдромов проходит две стадии – функциональную и органическую. Существует два механизма перехода одной стадии в другую: миогенный, когда спазм сосудов вызывает нарушение питания мышцы, а длительное ее сокращение способствует нарушению кровообращения в ней, и нейрогенный, когда сократившаяся мышца может сдавливать вегетативные волокна нервов, что в свою очередь ухудшает питание мышц. В формировании нейроваскулярных расстройств, определенную роль играет нарушение адаптационно-трофического влияния симпатической нервной системы.
Синдром плечо – кисть (нейроваскулярная дистрофия верхней конечности, Синдром Стейнброкера). Этот синдром является одним из самых распространенных нейроваскулярных синдромов конечностей. По механизму развития синдром плечо-кисть, как и плечелопаточный периартроз, рефлекторно возникающее поражение. Об этом свидетельствует так же то, что оно возникает, помимо дегенративно-дистрофических вертебральных причин, в результате патологической импульсации из очагов самой различной локализации при:
– травме различных тканей руки,
– травме шейных позвонков или плечевого сплетения,
– переломе луча в типичном месте,
– тромбофлебите вен руки и при диффузном васкулите,
– фурункулезе и дерматите,
– не нагнаивающемся панникулите,
– сосудистых и травматических заболеваниях головного мозга (дисфункция церебральных структур),
– при поражении легких и плевры.
Следует заметить, что при наличии шейного остеохондроза формированию синдрома плечо-кисть способствуют давние и свежие очаги поражения в тканях руки или близлежащих областей. Заболевание обычно развивается постепенно. Вначале возникает болезненная тугоподвижность плечевого сустава, затем поражение кисти. Возможен и обратный порядок развития. Иногда нарушения в области плечевого сустава и кисти развертываются самостоятельно. Больные испытывают жестокую боль в плече. Она сосредоточена в мышцах, надкостнице и других тканях и не поддается воздействию анальгетиков. Другим важным симптомом является контрактура мышц плечевого и лучеезапястного суставов, а также кисти. В клинической картине заболевания наряду с мышечно-тоническими нарушениями на первый план выступают вегетативно-сосудистые расстройства.
Дистальные вегетативные нарушения представлены разнообразными сосудистыми и трофическими феноменами, такими, как гипергидроз, акроцианоз, пузырьки на коже, покраснение ладонной поверхности кисти, истончение кожи, трофические нарушения ногтей и волос, уплотнение подкожной жировой клетчатки, повышение температуры кожи, дистальный отек. Характерным является феномен плотного ограниченного отека кожи и подкожной клетчатки тыла кисти со сглаженностью контуров пальцев. Кожа той области блестящая и гладкая, плотно натянутая, сухая с мелким шелушением. Со временем присоединяются мышечные атрофии, флексорная контрактура пальцев, остеопороз кисти (атрофия Зудека). Мышечная атрофия кисти, вазомоторные нарушения в ней без рентгенологических признаков остеопороза формируют синдром Холдена. Присоединение к рефлекторной дистрофии Зудека феномена отечной кисти характеризуется как синдром Оппенгеймера.
Учитывая вышеизложенное, различают три стадии процесса (Bateman J., 1972). Их можно назвать так: 1) стадия боли, 2) стадия уплотнений и 3) стадия атрофии.
Первая стадия боли (3-6 месяцев). Боль в плече и кисти, напряжение мышц надплечья, ограничение подвижности в плечевом суставе, тугоподвижность кисти и пальцев. Сжатие кисти в кулак сопровождается болью. Периостальные и сухожильные рефлексы на пораженной руке повышаются. Отек кисти ярко выражен, иногда переходит на нижнюю часть предплечья. Акроцианоз.
Вторая стадия уплотнений (3-6 месяцев). Боли и отек уменьшаются, но ткани кисти становятся плотными, возникают трофические расстройства. Похолодание кисти и пальцев. На рентгенограммах кисти признаки остеопороза.
Третья стадия атрофии (от нескольких месяцев до нескольких лет). Тугоподвижность плеча и пальцев, переходящая в необратимую контрактуру. Мышечные атрофии, остеопороз, понижение температуры кожи кисти нарастают.
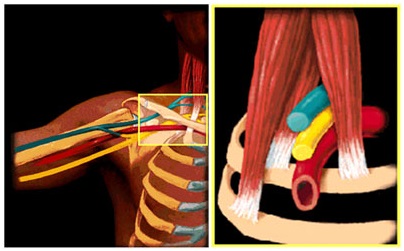
Скаленус – синдром (синдром Наффцигера). Клиническая картина скаленус-синдрома складывается из локальных признаков поражения передней лестничной мышцы в сочетании с картиной сдавления плечевого сплетения и подключичной артерии. развитие синдрома претерпевает две стадии: функциональную – без признаков органических изменений сосудов и органическую, когда выявляются стеноз и окклюзия подключичной артерии.
Синдром складывается из следующих компонентов: напряжение передней лестничной мышцы (болезненность, напряжение, утолщение) и сдавление плечевого сплетения. Основные клинические проявления синдрома связаны с рефлекторным напряжением передней лестничной мышцы, возникающим при раздражении III-IV шейных корешков и других структур смежных позвоночных двигательных сегментов. Из-за спазмированных мышц синдром проявляется ограничением наклона головы и шеи в здоровую сторону. Спазмированная мышца при любых причинах приподнимает I ребро, что вызывает сдавление подключичной артерии и плечевого сплетения. Отмечается легкая слабость руки, преимущественно её дистальных отделов, вплоть до грубых парезов кисти, особенно IV — V пальцев – мышц гипотенара. Снижение рефлексов и атрофия этих мышц встречается крайне редко – только в далеко зашедших случаях. Выявляется снижение поверхностной чувствительности в локтевой зоне руки. Иногда снижение чувствительности распространяется на всю руку, зону полукуртки или на всю половину тела. Сала мышц и чувствительность быстро восстанавливается после регресса спазма передней лестничной мышцы. В клинической картине поражения подключичной артерии довольно часто присутствуют вегетативные нарушения: бледность, акроцианоз, потливость кистей, трофические нарушения кожи и ногтей. Выделяют острое и постепенное развитие заболевания. При остром развитии чаще причиной является тяжелый физический труд (нагрузка на верхний плечевой пояс). В этом случае скаленус-синдром характеризуется болями в области плеча, надплечья, кисти; слабость, синюшность и отечность кисти. При постепенном развитии, разворачивающемся в течение нескольких дней – месяцев, выступают на первый план головные боли, головокружение (в следствие сдавления подключичной артерии) с последующим присоединением жалоб со стороны верхних конечностей.
. Вегетативно-сосудистые и трофические нарушения встречаются также в клинической картине реберно-ключичного синдрома (синдром Фолконера-Уэдла), синдром малой грудной мышцы (гиперабдукционный синдром, синдром Райта-Менделовича), синдром Персонейджа-Тернера (невралгическая амиотрофия), синдром Педжета-Шретера.
Этот сайт не является пособием по самолечению. Материалы, размещенные на данной странице, носят информационный характер и предназначены для образовательных целей.
Администрация сайта Мед.Центра «АльтМед» не несет ответственности за последствия использования представленных на сайте методов лечения и лекарственных средств.
За подробной информацией просьба обращаться по телефону или пишите нам
При использовании материалов ссылка на сайт обязательна.
Мед. Центр «АльтМед»
Адрес:
0033, Республика Армения, Ереван, Арабкир, ул. Акоп Акопян 3/15, 1-й этаж
Тел. (374-91) 42-10-02
Тел. (374-93) 22-92-92
All Rights Copyrighted | Все права защищены. | Բոլոր իրավունքները պաշտպանված են:
Боковой (латеральный) амиотрофический склероз (и синдром БАС)
Боковой (латеральный) амиотрофический склероз (БАС) (также известен как болезнь моторных нейронов, Мотонейронная болезнь, болезнь Шарко, в англоязычных странах — болезнь Лу Герига) — прогрессирующее, неизлечимое дегенеративное заболевание центральной нервной системы, при котором происходит поражение как верхних (моторная кора головного мозга), так и нижних (передние рога спинного мозга и ядра черепно-мозговых нервов) двигательных нейронов, что приводит к параличам и последующей атрофии мышц.
Болезнь известна не так давно. Впервые описана Жан-Мартеном Шарко в 1869г. По статистике выявляется у 2-5 человек на 100 000 населения в год, что говорит о том, что данная патология относительно редко встречается. Всего в мире насчитывается около 70 тысяч больных боковым амиотрофическим склерозом. Обычно заболевание заявляет о себе у людей старше 50 лет.
Совсем недавно было высказано мнение, что случаи бокового амиотрофического склероза чаще регистрируются у высокоинтеллектуальных людей, профессионалов в своем деле, а также у спортсменов-атлетов, которые на протяжении всей жизни отличались крепким здоровьем.
Точная этиология БАС неизвестна.
Сущность болезни заключается в дегенерации двигательных нейронов, т.е. под воздействием ряда причин запускается процесс разрушения нервных клеток, ответственных за сокращения мышц. Этот процесс затрагивает нейроны коры больших полушарий, ядер головного мозга и нейроны передних рогов спинного мозга. Двигательные нейроны погибают, а их функции никто больше не выполняет. Нервные импульсы к мышечным клеткам больше не поступают. И мышцы слабеют, развиваются парезы и параличи, атрофия мышечной ткани.
Если в основе бокового амиотрофического склероза лежит мутация в гене супероксиддисмутазы-1, то процесс выглядит примерно следующим образом. Мутантная супероксиддисмутаза-1 накапливается в митохондриях двигательных нейронов (в энергетических станциях клетки). Это «мешает» нормальному внутриклеточному транспорту белковых образований. Белки соединятся друг с другом, как бы слипаются, и это запускает процесс дегенерации клетки.
Если причиной становится избыток глутамата, то механизм запуска разрушения двигательных нейронов выглядит так: глутамат открывает каналы в мембране нейронов для кальция. Кальций устремляется внутрь клеток. Избыток кальция, в свою очередь, активирует внутриклеточные ферменты. Ферменты как бы «переваривают» структуры нервных клеток, при этом образуется большое количество свободных радикалов. И эти свободные радикалы повреждают нейроны, постепенно приводя к их полному разрушению.
Предполагается, что роль других факторов в развитии БАС также заключается в запуске свободнорадикального окисления.
Классификация БАС, формы:
Общими симптомами, характерными для любой из форм бокового амиотрофического склероза, являются:
Начальные проявления заболевания:
•слабость в дистальных отделах рук, неловкость при выполнении тонких движений пальцами, похудание в кистях и фасцикуляции (мышечные подергивания)
•реже заболевание дебютирует слабостью в проксимальных отделах рук и плечевом поясе, атрофиями в мышцах ног в сочетании с нижним спастическим парапарезом
•возможно также начало заболевания с бульбарных расстройств – дизартрии и дисфагии (25% случаев)
•крампи (болезненные сокращения, спазмы мышц), нередко генерализованные, встречаются практически у всех больных БАС, и нередко являются первым признаком заболевания
Для БАС в большинстве случаев характерна асимметричность симптоматики.
При этой форме заболевания возможно два варианта:
Также может дебютировать двумя способами:
В руках по мере прогрессирования болезни формируется парез с атрофическими изменениями, повышением рефлексов, повышением тонуса и патологическими стопными признаками. Аналогичные изменения возникают и в ногах, но несколько позже.
Это разновидность бокового амиотрофического склероза, когда заболевание протекает с преимущественным поражением центрального мотонейрона. При этом во всех мышцах туловища и конечностей формируются парезы с повышением мышечного тонуса, патологическими симптомами.
Бульбарная и высокая формы БАС являются прогностически неблагоприятными. Больные с таким началом заболевания имеют меньшую продолжительность жизни по сравнению с шейно-грудной и пояснично-крестцовой формами. Какими бы ни были первые проявления заболевания, оно неуклонно прогрессируют.
Парезы в различных конечностях приводят к нарушению способности самостоятельно передвигаться, обслуживать себя. Вовлечение в процесс дыхательной мускулатуры приводит вначале к появлению одышки при физической нагрузке, затем одышка беспокоит уже в покое, появляются эпизоды острой нехватки воздуха. В терминальных стадиях самостоятельное дыхание просто невозможно, больным требуется постоянная искусственная вентиляция легких.
Продолжительность жизни больного БАС составляет по разным данным от 2 до 12 лет, однако более 90% больных умирают в течение 5 лет от момента постановки диагноза. В терминальную стадию болезни больные полностью прикованы к постели, дыхание поддерживается с помощью аппарата искусственной вентиляции легких. Причиной гибели таких больных может стать остановка дыхания, присоединение осложнений в виде пневмонии, тромбоэмболии, инфицирования пролежней с генерализацией инфекции.
Среди параклинических исследований наиболее существенное диагностическое значение имеет электромиография. Выявляется распространенное поражение клеток передних рогов (даже в клинически сохранных мышцах) с фибрилляциями, фасцикуляциями, позитивными волнами, изменениями потенциалов двигательных единиц (увеличивается их амплитуда и длительность) при нормальной скорости проведения возбуждения по волокнам чувствительных нервов. Содержание КФК в плазме может быть незначительно повышено
Боковой амиотрофический склероз нужно заподозрить:
•при развитии слабости и атрофий, а возможно и фасцикуляций (мышечных подергиваний) в мышцах кисти
•при похудания мышц тенара одной из кистей с развитием слабости аддукции (приведения) и оппозиции большого пальца (обычно асимметрично)
•при этом наблюдается затруднение при схватывании большим и указательным пальцами, затруднения при подбирании мелких предметов, при застегивании пуговиц, при письме
•при развитии слабости в проксимальных отделах рук и плечевом поясе, атрофий в мышцах ног в сочетании с нижним спастическим парапарезом
•при развитии у пациента дизартрии (нарушений речи) и дисфагии (нарушений глотания)
•при появлении у пациента крампи (болезненных мышечных сокращений)
Диагностические критерии БАС:
Критерии подтверждения БАС:
Диагноз БАС подьверждается:
Дифференциальный диагноз БАС (синдромы похожие на БАС):
•Спондилогенная шейная миелопатия.
•Опухоли краниовертебральной области и спинного мозга.
•Краниовертебральные аномалии.
•Сирингомиелия.
•Подострая комбинированная дегенерация спинного мозга при недостаточности витамина В12.
•Семейный спастический парапарез Штрюмпеля.
•Прогрессирующие спинальные амиотрофии.
•Постполиомиелитический синдром.
•Интоксикации свинцом, ртутью, марганцем.
•Недостаточность гексозаминидазы типа А у взрослых при ганглиозидозе GM2.
•Диабетическая амиотрофия.
•Мультифокальная моторная невропатия с блоками проведения.
•Болезнь Крейцтфельдта-Якоба.
•Паранеопластический синдром, в частности при лимфогранулематозе и злокачественной лимфоме.
•Синдром БАС при парапротеинемии.
•Аксональная нейропатия при болезни Лайма (Лайм-боррелиозе).
•Синдром Гийена-Барре.
•Миастения.
•Рассеянный склероз
•Эндокринопатии (тиреотоксикоз, гиперпаратиреоз, диабетическая амиотрофия).
•Доброкачественные фасцикуляции, т.е. фасцикуляции, продолжающиеся годами без признаков поражения двигательной системы.
•Нейроинфекции (полиомиелит, бруцеллез, эпидемический энцефалит, клещевой энцефалит, нейросифилис, болезнь Лайма).
•Первичный боковой склероз.
Диагностические исследования при синдроме БАС.
Для уточнения диагноза и проведения дифференциального диагноза при синдроме БАС рекомендутся следующее обследование больного:
Анализ крови (СОЭ, гематологические и биохимические исследования)
Рентгенография органов грудной клетки
Исследование функций щитовидной железы
Определение содержания витамина В12 и фолиевой кислоты в крови
Креатинкиназа в сыворотке
МРТ головного мозга и при необходимости, спинного мозга
Эффективного лечения заболевания не существует. Единственный препарат, ингибитор высвобождения глутамата рилузол (Рилутек), отодвигает летальный исход на 2 – 4 месяца. Его назначают по 50 мг два раза в день.
Основу лечения составляет симптоматическая терапия:
•Физическая активность. Пациент должен по мере своих возможностей поддерживать физическую активность По мере прогрессирования заболевания возникает необходимость в кресле-каталке и других специальных приспособлениях.
•Диета. Дисфагия создаёт опасность попадания пищи в дыхательные пути • Иногда возникает необходимость в питании через зонд или в гастростомии.
•Применение ортопедических приспособлений: шейного воротника, различных шин, устройств для захвата предметов.
•При крампи (болезненным мышечных спазмах): карбамазепин (Финлепсин, Тегретол) и/или витамин Е, а также препараты магния, верапамил (Изоптин).
•При спастичности: баклофен (Баклосан), Сирдалуд, а также клоназепам.
•При слюнотечении атропин, или гиосцин (Бускопан).
•При невозможности приема пищи вследствие нарушения глотания накладывают гастростому или вводят назогастральный зонд. Раннее проведение чрезкожной эндоскопической гастростомии продлевает жизнь пациентов в среднем на 6 месяцев.
•Церебролизин в высоких дозах (10-30 мл в/в капельно 10 дней повторными курсами). Существует ряд небольших исследований, показывающих нейропротективную эффективность церебролизина при БАС.
•Антидепрессанты: Серталин или Паксил или Амитриптилин (часть больных БАС предпочитает именно его как раз из-за побочных действий – он вызывает сухость во рту, соответственно уменьшает гиперсаливацию (слюнотечение), часто мучающую больных БАС).
•При появлении дыхательных нарушений: искусственная вентиляция легких в условиях стационаров, как правило, не проводится, но некоторые больные приобретают портативные приборы ИВЛ и проводят ИВЛ в домашних условиях.
•Ведутся разработки к применению гормона роста, нейротрофических факторов при БАС.
•Последнее время активно ведутся разработки лечения стволовыми клетками. Этот метод обещает быть перспективным, но все же пока находится на стадии научных экспериментов.
•Боковой амиотрофический склероз является фатальным заболеванием. Средняя продолжительность жизни больных БАС 3 – 5 лет, тем не менее, 30% больных живут 5 лет, а около 10 – 20% живут более 10 лет от начала заболевания.
•Неблагоприятные прогностические признаки – пожилой возраст и бульбарные нарушения (после появления последних больные живут не более 1 – 3 лет).
Нейроваскулярный конфликт с компрессией двигательной порции тройничного нерва: гемимастикаторный спазм и синдром Парри — Ромберга. Клиническое наблюдение
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Наиболее распространенной причиной нейроваскулярного конфликта (НВК) является компрессия артериальным или венозным сосудом волокон чувствительной порции корешка тройничного нерва непосредственно у ствола головного мозга. Это ведет к локальной демиелинизации, проявляющейся классической тригеминальной невралгией. Реже в патологический процесс вовлекается двигательная порция тройничного нерва. Нами представлено клиническое наблюдение 26-летнего пациента с верифицированным НВК двигательной порции тройничного нерва. Заболевание дебютировало интенсивными болевыми пароксизмами в левой части лица, которым предшествовал спазм жевательных мышц, сопровождающийся сжатием челюстей, прикусыванием языка (гемимастикаторный спазм, ГМС). Через некоторое время после дебюта заболевания развилась гемиатрофия лица с признаками локализованной склеродермии. Диагноз НВК с компрессией двигательной порции тройничного нерва с развитием ГМС и синдрома Парри — Ромберга был подтвержден данными МРТ головного мозга в режиме FIESTA и игольчатой миографией. В дальнейшем имел место спонтанный регресс симптоматики. Обсуждаются концепции ГМС и гемиатрофии лица. Редкость представленной патологии, недостаточная информация о компрессии двигательного корешка тройничного нерва при НВК, необычность дебюта заболевания и его клинических проявлений делают вопрос интересным для широкого круга специалистов.
Ключевые слова: нейроваскулярный конфликт, гемимастикаторный спазм, гемиатрофия лица, синдром Парри — Ромберга, тригеминальная невралгия, тройничный нерв, локализованная склеродермия, оромандибулярная дистония.
Для цитирования: Матвеева Т.В., Казанцев А.Ю., Алескерова А.Б., Гайфутдинов Р.Т. Нейроваскулярный конфликт с компрессией двигательной порции тройничного нерва: гемимастикаторный спазм и синдром Парри — Ромберга. Клиническое наблюдение. РМЖ. Медицинское обозрение. 2021;5(10):668-673. DOI: 10.32364/2587-6821-2021-5-10-668-673.
1 Kazan State Medical University, Kazan, Russian Federation
2 Medical Wing of the Ministry of Internal Affairs in the Republic of Tatarstan, Kazan,
Russian Federation
The most common cause of neurovascular conflict (NVC) is the compression of the sensory portion of the trigeminal nerve root by artery or vein directly at the brainstem. This results in local demyelination manifested as the classic trigeminal neuralgia. The motor portion of the trigeminal nerve is affected less commonly. The authors describe a case history of a 26-year-old man with a verified NVC of the motor portion of the trigeminal nerve. At the onset, the disease manifested as intense pain paroxysms in the left side of the face preceded by a masseter muscle spasm that was accompanied by lockjaw and tongue biting (hemimasticatory spasm). Shortly after disease onset, facial hemiatrophy with local scleroderma developed. The diagnosis of NVC with the compression of the motor portion of the trigeminal nerve accompanied by hemimasticatory spasm and Parry-Romberg syndrome was verified by brain FIESTA MRI and needle EMG. Later on, these symptoms spontaneously regressed. Concepts of hemimasticatory spasm and facial hemiatrophy are discussed. The rarity of this condition, lack of information on the compression of the motor portion of the trigeminal nerve in NVC, unusual disease onset, and presentations make this issue interesting for a wide range of experts.
Keywords: neurovascular conflict, hemimasticatory spasm, facial hemiatrophy, Parry-Romberg syndrome, trigeminal neuralgia, trigeminal nerve, local scleroderma, oromandibular dystonia.
For citation: Matveeva T.V., Kazantsev A.Yu., Aleskerova A.B., Gaifutdinov R.T. Neurovascular conflict with the compression of the motor portion of the trigeminal nerve: hemimasticatory spasm and Parry-Romberg syndrome. Case report. Russian Medical Inquiry. 2021;5(10):668–673 (in Russ.). DOI: 10.32364/2587-6821-2021-5-10-668-673.
Введение
Нейроваскулярный конфликт (НВК) — это сдавление черепного нерва сосудом. Компрессии может быть подвергнут любой черепной нерв [1]. Самый известный НВК ассоциирован с классической невралгией тройничного нерва, симптомы, патогенез и этиология которой широко освещены в научной литературе [2]. Реже встречается НВК, обусловленный вовлечением двигательной порции тройничного нерва, протекающий с гемимастикаторным спазмом (ГМС) или его сочетанием с гемиатрофией лица (синдром Парри — Ромберга). При этом сосудами, контактирующими с корешком тройничного нерва, являются верхняя мозжечковая артерия или передняя нижняя мозжечковая артерия [3].
Представляем клиническое наблюдение пациента с компрессией двигательной порции тройничного нерва, дебютом в виде ГМС с последующей гемиатрофией лица.
Клиническое наблюдение
Пациент Р., 26 лет, обратился на амбулаторный прием примерно через год от начала заболевания с жалобами на стягивающие, труднопереносимые боли (9–10 баллов по визуальной аналоговой шкале (ВАШ)) в околоушной области слева, иногда в подбородочной зоне с той же стороны без иррадиации. Болям предшествовал спазм жевательных мышц. В момент спазма сжимались челюсти с неоднократным прикусыванием языка. Иногда во время приступа челюсть смещалась вправо. Боль в височно-нижнечелюстном суставе не возникала. Приступы продолжались несколько секунд. Вне приступа боли не беспокоили. Частота приступов варьировала от 20 до 30 раз в день. Приступ мог быть спровоцирован разговором, жеванием, но мог возникнуть и в покое. Больной избегал разговоров и приема пищи, требующей жевания. Частота и характер приступов за истекший промежуток времени (до момента обращения) не изменились. Отметил, что «похудела левая половина лица», но, когда это случилось, точно сказать не мог, утверждал, что спустя длительный промежуток времени после возникновения первых приступов. За месяц до обращения в области виска слева выпали волосы на участках в виде двух округлых пятен диаметром около 2 см. Слева в теменно-лобной области на волосистой части головы и на подбородке появились глубокие полосы длиной 2,5 см, а также участки облысения. В связи с продолжающимися приступами боли и предположением стоматологической патологии были удалены моляры («зубы мудрости»), был назначен линкомицин сроком на 3 нед. Описанные пароксизмы исчезли, на участках облысения стали расти волосы, исчезли «рубцы» на лбу. На подбородке они приобрели меньшую протяженность и стали менее глубокими. Однако «похудание лица увеличилось», появились участки, прикосновение к которым могло вызвать боль и сжатие челюстей. Однако оно не было сильным и боли были терпимыми (5–6 баллов по ВАШ). Хронические заболевания отрицал.
Объективно: высокого роста, правильного телосложения с хорошо развитой мускулатурой. Неубедительная анизокория S Литература
Только для зарегистрированных пользователей