Нейроэндокринная опухоль поджелудочной железы что это
Нейроэндокринные опухоли поджелудочной железы
Нейроэндокринные опухоли поджелудочной железы (НЭОПЖ) – большая группа опухолей, по характеру течения заболевания, занимающих промежуточное положение между доброкачественными и злокачественными опухолями. НЕОПЖ развиваются из клеток поджелудочной железы, имеющих некоторые общие черты с клетками нервной системы и способными вырабатывать различные биологически активные вещества (БАВ). Поэтому иногда о развитии такой опухоли можно судить по наличию специфических симптомов – так называемого гормонального синдрома. Особенности этих симптомов определяются тем гормоном, который продуцируется опухолью в большем количестве. Например, при избыточной выработке инсулина болезнь проявляется увеличением веса, чувством голода, частыми обморочными состояниями, сопровождающимися потливостью.
При синдроме Золлингера-Эллисона, обусловленном повышением содержания в крови синтезируемого опухолью гастрина, характерным является развитие упорных к лечению, в том числе хирургическому, язв желудка, двенадцатиперстной кишки и начальных отделов тощей кишки. Болезнь проявляется редицивирующими желудочно-кишечными кровотечениями.
При карциноидном синдроме, в основе которого лежит гиперпродукция серотонина, больных часто беспокоят приступы удушья, сопровождающиеся приливами крови к лицу, шее, неустойчивый стул, нередко развиваются пороки сердца. Существуют другие гормональные синдромы. Однако часто клетки НЕОПЖ не продуцируют клинически значимых БАВ, поэтому гормональный синдром отсутствует. В этом случае опухоль чаще обнаруживает себя, только достигнув крупных размеров.
Для диагностики НЭОПЖ используются те же методы исследования, что и при раке поджелудочной железы, а также анализ крови на наличие специфических БАВ. Со злокачественными опухолями НЕОПЖ объединяет возможность метастазирования в другие органы. Однако в отличие от большинства злокачественных опухолей, НЭОПЖ растут медленно. Поэтому хирургическое лечение, направленное на удаление первичной опухоли и метастазов, возможно и рекомендуется на всех стадиях заболевания. Тем более, что НЭОПЖ весьма чувствительны к химио- и иммунотерапии.
Объем операции на поджелудочной железе в зависимости от размеров опухоли варьирует от экономных резекций до больших и травматичных вмешательств на органе.
Нейроэндокринная опухоль поджелудочной железы что это
1. Аббревиатура:
• Нейроэндокринная опухоль (НЭО) поджелудочной железы
2. Синоним:
• Островковоклеточная опухоль
3. Определение:
• Опухоль из эндокринных клеток ПЖ (островков Лангерганса)
4. Ассоциированные синдромы:
• Множественная эндокринная неоплазия первого типа (МЭН 1, гастриномы), синдром Гиппеля-Линдау, нейрофиброматоз первого типа, туберозный склероз
1. Общая характеристика:
• Лучший диагностический критерий:
о Гиперваскулярное объемное образование поджелудочной железы, хорошо отграниченное от окружающих тканей, дающее гиперваскулярные метастазы в печени
• Локализация:
о В 85% случаев опухоли располагаются в поджелудочной железе, в 15% случаев являются эктопическими:
— Наиболее часто встречающиеся локализации эктопических нейроэндокринных опухолей: двенадцатиперстная кишка, желудок, лимфоузлы, яичники
о Гастриномы в 90% случаев возникают в т. н. «треугольнике гастрином»:
— Треугольник ограничен сверху пузырным протоком и ОЖП, снизу второй и третьей частью двенадцатиперстной кишки, с внутренней стороны шейкой и телом ПЖ
— Эктопические гастриномы чаще всего возникают в стенке двенадцатиперстной кишки
• Размер:
о От нескольких миллиметров до 10 см
• Общие концепции:
о Встречаются реже, чем опухоли экзокринной части ПЖ
о Согласно классификации ВОЗ подразделяются на доброкачественные (эндокринные опухоли высокой степени дифференцировки) и злокачественные (высоко- или низкодифференцированный нейроэндокринный рак)
о Больше не подразделяются на функционирующие и нефункционирующие, поскольку в настоящее время все нейроэндокринные опухоли расцениваются как гормонально активные
о Выделяются синдромальные (вызывающие развитие клинического синдрома и изменения лабораторных данных) и несиндромные опухоли:
— Синдромальные опухоли: секретируют различные гормоны ПЖ; развивается определенный клинический синдром:
Инсулинома, глюкагонома, гастринома, соматостатинома, випома (опухоль, продуцирующая вазоактивный интестинальный полипептид), карциноид
— Внесиндромные опухоли:
Являются гипофункциональными или клинически «немыми», имеют большой размер
На момент установления диагноза имеют больший размер по сравнению с синдромальными опухолями, поскольку не приводят к появлению симптоматики или изменениям лабораторных данных
Кистозные нейроэндокринные опухоли чаще бывают внесиндромными и не продуцируют инсулин
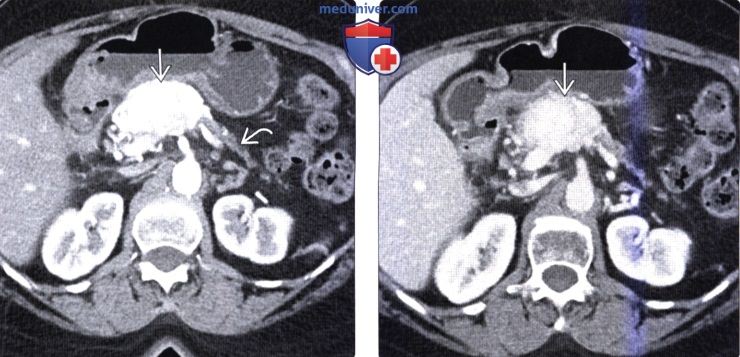
(Справа) На аксиальной КТ в венозной фазе контрастного усиления у этого же пациента опухоль по-прежнему накапливает контраст, но в значительно меньшей степени, чем в артериальной фазе. 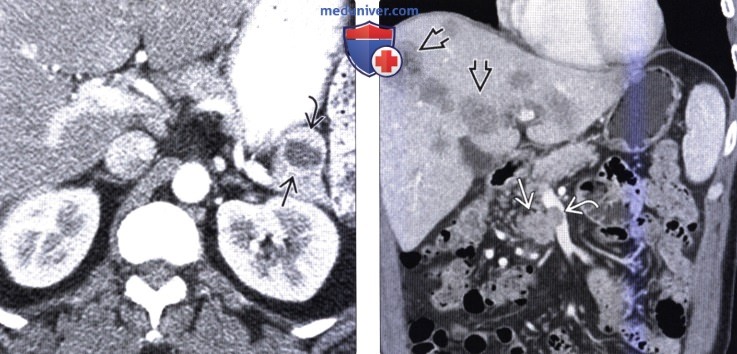
(Справа) На корональной КТ с контрастным усилением визуализируется гиповаскулярное объемное образование в крючковидном отростке поджелудочной железы на фоне многочисленных метастазов в печени.Опухоль прорастает в верхнюю брыжеечную вену, что не типично для аденокарциномы, и больше характерно для нейроэндокринной опухоли. 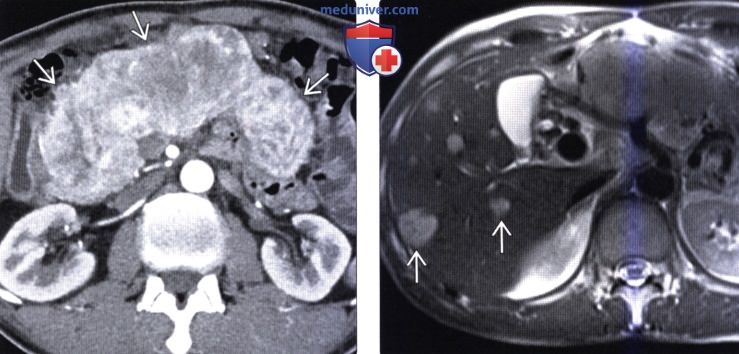
(Справа) На аксиальной Т2 взвешенной томограмме у этого же пациента визуализируются гиперинтенсивные очаги в печени. Несмотря на то, что они могут с легкостью быть ошибочно расценены как кисты или гемангиомы, нужно учитывать, что метастазы нейроэндокринных опухолей в печень также могут обладать крайне высокой интенсивностью сигнала на Т2 ВИ.
2. КТ признаки нейроэндокринной опухоли поджелудочной железы:
• Объемное образование ПЖ неинфильтративного характера с четкими контурами, которое обычно (но не всегда) является гиперваскулярным и наиболее хорошо заметно в артериальной фазе:
о В венозной фазе чаще всего накапливают контраст не так интенсивно, из-за чего небольшие опухоли сложно различить:
— Могут становиться заметнее в венозной фазе (редко)
о Синдромальные опухоли обычно имеет меньшие размеры на момент обнаружения ( 5 см):
— Обычно являются гиперваскулярными, но не в такой степени, как синдромальные опухоли
— В крупных опухолях вероятнее наличие центрального некроза, кистозных изменений, кальцинатов
• В нейроэндокринных опухолях часто обнаруживаются кальцинаты (в центре или с диффузным распределением)
• В большинстве случаев НЭО (за исключением крупных) не приводят к панкреатобилиарной обструкции и атрофии паренхимы вышележащих отделов поджелудочной железы:
о Редко некоторые небольшие опухоли могут продуцировать серотонин, что приводит к фиброзу и обструкции протока поджелудочной железы (ППЖ)
• Опухоль чаще прорастает в воротную или верхнюю брыжеечную вену, а не охватывает их
• Кистозные нейроэндокринные опухоли могут имитировать другие кистозные новообразования поджелудочной железы:
о Периферическое нодулярное накопление контраста в артериальной фазе является характерным признаком нейроэндокринной опухоли
• Метастазы в печени и вторично измененные лимфатические узлы выглядят так же, как первичная опухоль, и являются гиперваскулярными:
о Чаще всего метастазы выявляются в печени, лимфоузлах возле опухоли, а также в костях (склеротического характера)
о Уровень «жидкость-жидкость» в метастазах эндокринных опухолей в печени описывается как специфический признак
• Синдром Золлингера-Эллисона (при гастриноме): утолщение стенки проксимальных отделов желудка и интенсивное накопление ею контраста
в) Дифференциальная диагностика нейроэндокринной опухоли поджелудочной железы:
2. Протоковый рак поджелудочной железы:
• Гиповаскулярная опухоль инфильтративного характера, вызывающая обструкцию ППЖ и/или ОЖП и атрофию паренхимы ПЖ
• В отличие от нейроэндокринных опухолей практически никогда не содержит обызвествления
• Охватывает брыжеечные вены и вызывает сужение их просвета, но не приводит к появлению опухолевых тромбов
3. Вторичное поражение поджелудочной железы:
• Гиперваскулярные метастазы в поджелудочной железе (преимущественно почечноклеточного рака) неотличимы от НЭО
4. Серозная цистаденома поджелудочной железы:
• Опухоль в виде «губки», состоящая из множественных мелких кист, разделенных перегородками, накапливающими контраст
• Солидный вариант, выглядящий как гиперваскулярное объемное образование, иногда невозможно отличить от НЭО
5. Гастроинтестинальная стромальная опухоль, прилежащая к поджелудочной железе:
• Новообразование желудка или двенадцатиперстной кишки может имитировать НЭО ПЖ, особенно, если активно накапливает контраст
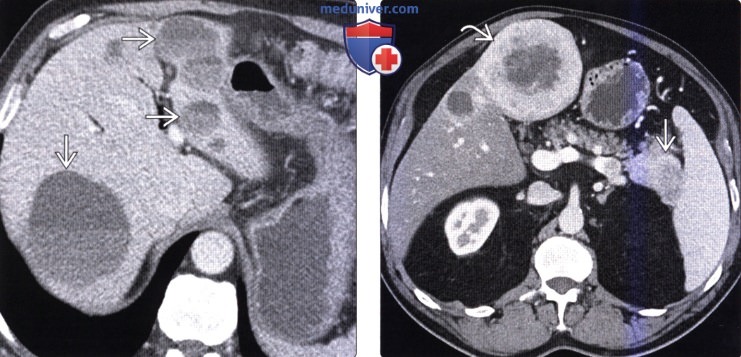
(Справа) На аксиальной КТ с контрастным усилением визуализируется гиперваскулярное объемное образование в хвосте поджелудочной железы, сопоставимое с нейроэндокринной опухолью. Обратите внимание, что крупный метастаз в печени накапливает контраст примерно так же, как первичная опухоль в поджелудочной железе. 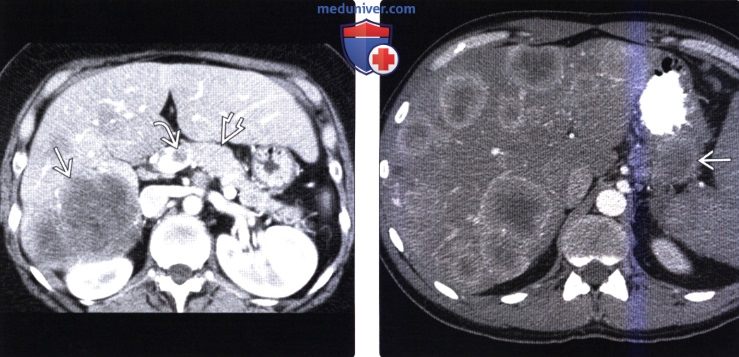
(Справа) На аксиальной КТ в артериальной фазе контрастного усиления в печени визуализируются многочисленные гиперваскулярные метастазы первичной НЭО поджелудочной железы. Первичная опухоль и ее метастазы, как наблюдается и в этом случае, часто представляют собой образования с повышенной васкуляризацией, обнаруживаемой в артериальной фазе. 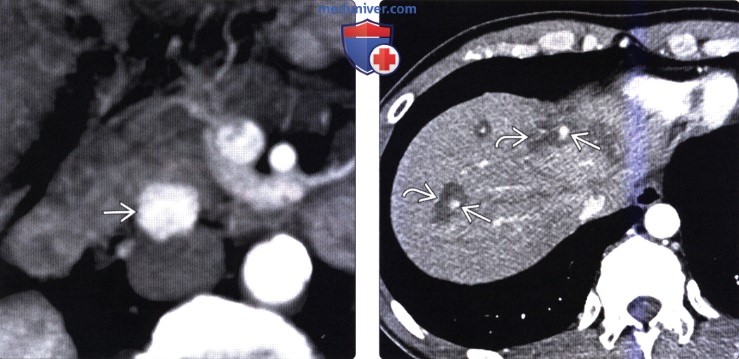
(Справа) На аксиальной КТ с контрастным усилением у этого же пациента в печени визуализируются множественные гиподенсные участки стеатоза, окружающие маленькие гиперваскулярные метастазы. Возникновение стеатоза вокруг очагов, скорее всего, обусловлено влиянием инсулина, продуцируемого функционирующими метастазами, являясь хотя и редким, но известным проявлением метастатической инсулиномы.
г) Патология. Общая характеристика:
• Этиология:
о Опухоль возникает из апудоцитов (APUD-клеток), в которых происходит накопление аминов-предшественников о Патогенез и проявления:
— Инсулинома: опухоль из бета-клеток → гиперинсулинемия — гипогликемия
— Гастринома: островковоклеточная опухоль → повышение секреции гастрина → повышение кислотности желудочного сока → пептические язвы
— Глюкагонома: опухоль из альфа-клеток → ↑ уровня глюкагона → классическая кожная сыпь и сахарный диабет
• Генные изменения:
о МЭН 1 (гиперпаратиреоз, аденома гипофиза, НЭО ПЖ):
— Заболевание с аутосомно-доминантным типом наследования
— В 80% случаев приводит к развитию НЭО, часто множественных
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Синдромальные опухоли:
— Инсулинома: симптомы гипогликемии, I уровня глюкозы ( 2 см) напрямую связан с вероятностью ее злокачественности
4. Лечение:
• Аналоги соматостатина, такие как октреотид, применяются для снижения выраженности симптоматики при синдромальных опухолях за исключением соматостатиномы
• При синдромальных или доброкачественных несиндромных НЭО при отсутствии метастазов необходимо хирургическое вмешательство (резекция)
• НЭО, распространяющиеся за пределы ПЖ, при отсутствии метастазов должны удаляться если это возможно, даже если не удается добиться отсутствия клеток опухоли по краю резекции:
о Оперативное вмешательство позволяет снизить выраженность симптоматики и улучшить выживаемость
• Резекция первичной НЭО, даже при наличии метастазов в печени, может способствовать увеличению выживаемости
о В некоторых случаях может быть выполнена резекция или циторедуктивная операция (при метастазах в печени)
• У пациентов с печеночной недостаточностью и метастазами, ограниченными печенью, возможна трансплантации печени
е) Список использованной литературы:
1. Kawamoto S et аI.: Pancreatic neuroendocrine tumor with cystlike changes: evaluation with MDCT. AJR Am J Roentgenol. 200(3):W283-90, 2013
Редактор: Искандер Милевски. Дата публикации: 12.3.2020
«Иммунный след» в нейроэндокринном раке поджелудочной железы
Рак поджелудочной железы
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Рак поджелудочной железы и в наши дни остается одним из наиболее агрессивных, трудно диагностируемых и плохо поддающихся лечению видов злокачественных опухолей. Возможно, причина кроется в том, что клетки этой опухоли маскируются под здоровые и поэтому плохо распознаются клетками иммунной системы. Однако существует такой вид рака поджелудочной железы, на который иммунная система реагирует. Именно о нем и рассказывает эта статья.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Что такое рак поджелудочной железы?
Поджелудочная железа (ПЖ) — железа смешанной секреции (экзоэндокринная), поскольку она выполняет две разные функции:
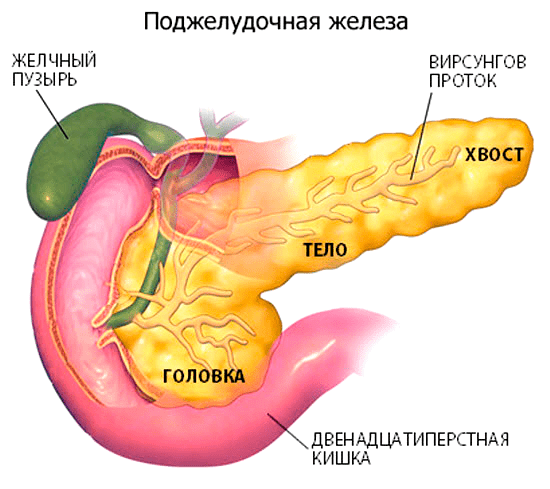
Рак поджелудочной железы — злокачественная опухоль, образующаяся из клеток эпителия поджелудочной железы в результате генетических изменений. В поджелудочной железе выделяют три отдела: головку, тело и хвост. Чаще всего опухоль локализуется в головке железы, прилегающей к луковице двенадцатиперстной кишки, куда открывается общий желчный проток — естественный дренаж для оттока желчи (рис. 1). Опухоль прорастает в этот проток, закупоривая его, вследствие чего отток желчи нарушается, и появляется подозрительный симптом заболевания: желтуха. В этом случае можно выявить рак на ранней стадии и успешно побороть его. При локализации опухоли в теле или хвосте поджелудочной железы желтухи не бывает, что затрудняет проведение диагностики и ухудшает прогноз лечения.
Рисунок 1. Анатомия поджелудочной железы. Головка поджелудочной железы непосредственно прилегает к двенадцатиперстной кишке, в которую открывается общий желчный проток, являющийся естественным дренажем для оттока желчи. Если раковая опухоль локализуется в этом отделе поджелудочной железы, то она глубоко прорастает в проток и закупоривает его, что приводит к нарушению оттока желчи и развитию механической желтухи. Прежде всего окрашиваются желтым цветом белки глаз, затем слизистые оболочки и в последнюю очередь кожа.
Нейромедиаторы — биологически активные вещества, необходимые для передачи нервных импульсов от клетки к клетке.
Стоит отметить, что нейроэндокринный рак поджелудочной железы встречается редко, является гетерогенным заболеванием и так же, как любой другой рак, взаимодействует с иммунной системой.
Молекулярные подтипы нейроэндокринного рака поджелудочной железы
Современные молекулярно-генетические методы позволяют изучить опухоли на уровне транскриптома, и нередко в результате оказывается, что один вид злокачественного новообразования по своим молекулярным характеристикам может быть разделен на несколько. Это и случилось в недавнем исследовании английских и итальянских ученых, которые провели секвенирование транскриптомов биоптатов нейроэндокринного рака поджелудочной железы [1]. В результате были выявлены 4 молекулярных подтипа, отличавшиеся друг от друга, в первую очередь, активностью определенных генов (рис. 2).
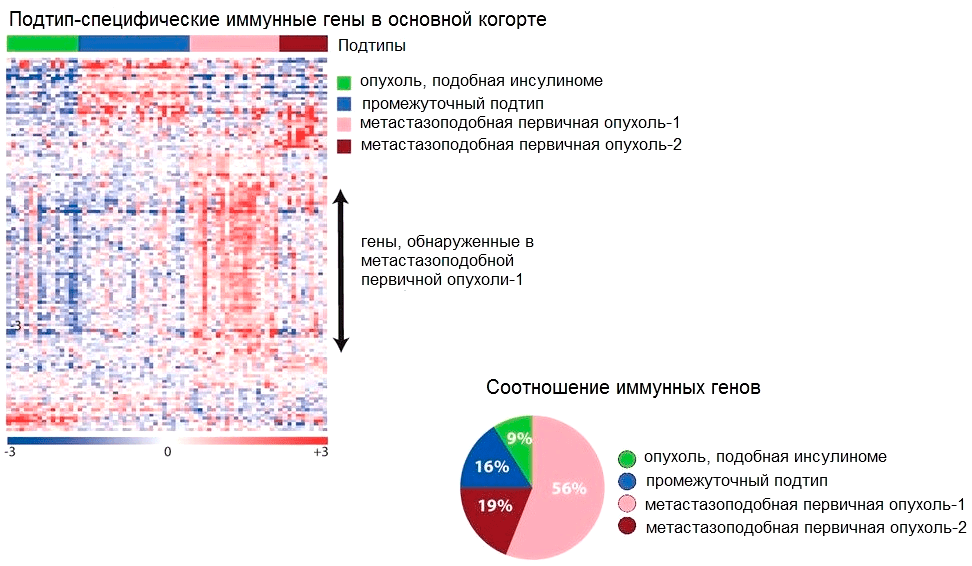
Рисунок 2. Тепловая карта, отображающая уровни экспрессии «иммунных» генов (справа), и диаграмма, отображающая процентное соотношение количества экспрессируемых иммунных генов (слева) в четырех подтипах нейроэндокринных опухолей поджелудочной железы. Самый богатый иммунными генами подтип — метастазоподобная первичная опухоль-1.
Клетки иммунной системы (лейкоциты) мигрируют в нейроэндокринную опухоль, инфильтрируют ее и экспрессируют гены, связанные с иммунитетом.
Самый «иммунный» из всех молекулярных подтипов нейроэндокринных опухолей ПЖ — это метастазоподобная первичная опухоль-1 (metastasis-like primary tumour-1, MLP-1). Встречающиеся в ней иммуноциты экспрессируют 56% иммунных генов (рис. 2), которые ученые разделили на две группы (рис. 3):
Первая группа — гены, кодирующие активированные Т-лимфоциты и белки-цитокины (интерфероны, интерлейкины, стимуляторы интерферонов).
Вторая группа — гены моноцитов/макрофагов и дендритных клеток, необходимые для процессинга (переработки) антигенов.
Рисунок 3. Тепловая карта, отображающая уровни экспрессии 19 идентифицированных иммунных генов в нейроэндокринных опухолях поджелудочной железы. Верхняя полоса указывает на подтип. На радужной шкале под тепловой картой красный цвет (+1 балл) означает высокий уровень экспрессии иммунных генов, синий (–1 балл) — низкий, белый (0 баллов) — отсутствие экспрессии генов. В подтипе MLP-1 наиболее ярко выражена экспрессия генов LAG3, IFI16, SPP1, CCRL2, TREM2, ANXA1.
Некроптоз — запрограммированная некротическая гибель клетки, запускаемая через рецепторы смерти (например, через рецептор фактора некроза опухоли) и имеющая, в отличие от некроза, четкую систему регуляции: регулируется протеинкиназами — ферментами, которые модифицируют белки. При некроптозе так же, как и при апоптозе происходит образование активных форм кислорода в митохондриях, но не происходит фрагментации ДНК.
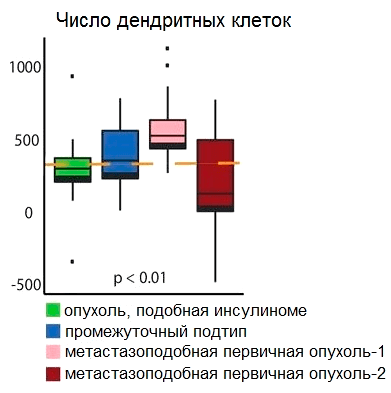
В поисках ответа на вопрос, почему так происходит, исследователи обнаружили, что в организме больных нейроэндокринным раком поджелудочной железы дендритные клетки (клетки, которые знакомят «наивные» Т-лимфоциты с антигенами) интенсивно синтезируют toll-подобный рецептор 3 (TLR3), лигандом которого является двуцепочечная РНК, появляющаяся при некроптозе. Кроме того, увеличивается количество дендритных клеток (рис. 4), следовательно, повышается уровень экспрессии TLR3, и это стимулирует синтез белков DAMP.
Рисунок 4. Диаграмма, отображающая количество дендритных клеток в четырех различных молекулярных подтипах нейроэндокринных опухолей поджелудочной железы
Исходя из того, что некроптоз является некротической гибелью клеток, для успешного лечения следует исключить те условия, в которых это будет происходить. Опухоль — это живой орган, который питается кислородом. Недостаток кровоснабжения (ишемия) ведет к гипоксии, которая и является условием для возникновения и усиления некроптоза. Клетки опухоли (в том числе и нейроэндокринной) обладают уникальной способностью способствовать появлению новых сосудов (ангиогенезу). Однако такие сосуды дефектны, они не выполняют свою функцию должным образом, вследствие чего опухолевые клетки испытывают стресс. Далее вступает в игру естественный отбор: уязвимые клетки погибают, резистентные клетки мигрируют по сосудам в близлежащие лимфатические узлы, а также в отдаленные органы и ткани, формируя вторичные очаги опухоли — метастазы (клоны опухоли). Этот процесс называется метастазированием. Он является одной из главных стратегий выживания опухоли в организме. Стимуляция же кровотока в опухоли способствует ее интенсивному росту, что ухудшает прогноз. Однако это единственный способ избежать некроптоза, так как DAMP-молекулы вводят иммунную систему в заблуждение, вследствие чего она не может уничтожить опухоль. Замкнутый круг, верно?
В итоге, для того чтобы научиться лечить такие опухоли, нам необходимо более подробно исследовать механизмы ангиогенеза, проанализировать уровень цитокинов, генов, которые экспрессируют различные клетки микроокружения опухоли помимо иммуноцитов. Также можно выявить и новые белки-регуляторы некроптоза. Все это в перспективе поможет победить один из самых агрессивных видов рака.
Нейроэндокринные опухоли поджелудочной железы
НЭО встречаются редко и составляют 0,5-1% от всех злокачественных опухолей человека. Большинство исследователей отмечают увеличение частоты заболеваемости за последние 30 лет, с ежегодным приростом заболеваемости на 3%. Наиболее частой локализацией НЭО является желудочно-кишечный тракт (ЖКТ) (73%) и бронхо-легочная система (25%). Среди всех злокачественных опухолей гастроэнтеропанкреатической зоны доля НЭО составляет 2% [1]. В пределах ЖКТ большинство опухолей локализуются в тонкой кишке (28,7%), червеобразном отростке (18,9%) и прямой кишке (12,6%). Ежегодная частота возникновения НЭО поджелудочной железы колеблется от 3 до 10 случаев на 1 000 000 населения. Инсулинома – наиболее распространенная функционирующая НЭО поджелудочной железы (заболеваемость составляет 1-6 случаев на 1 000 000 населения). Заболеваемость НЭО у мужчин выше, чем у женщин (соотношение 2,6:1.8) [1]. Наиболее часто болезнь диагностируют у пациентов в возрасте от 50 до 60 лет [2].
Этиология и патогенез
Молекулярные основы патогенеза НЭО недостаточно изучены. Зачастую возникновение НЭО носит спорадический характер, реже (в 10% случаев) опухоль может быть ассоциирована с генетическими синдромами: множественная эндокринная неоплазия I типа (МЭН I или синдром Вернера), синдром Гиппеля-Линдау, нейрофиброматоз I типа (NF-I, болезнь Реклингхаузена) и туберозный склероз (TSC). Дальнейшее изучение этих синдромов может во многом объяснить и механизмы патогенеза НЭО [5].
Клиника, диагностика и классификация
В клинической практике принято разделять НЭО на гормонально активные (функционирующие) и гормонально неактивные (нефункционирующие). В большинстве случаев (68–90%) диагностируются гормонально неактивные опухоли поджелудочной железы [6]. Как правило, клинические проявления при НЭО отсутствуют до возникновения осложнений или могут быть очень разнообразными, что обусловлено способностью опухолей секретировать различные биологически активные пептиды. Поэтому ранняя диагностика первичной опухоли и метастазов у данного контингента больных затруднена.
В диагностике НЭО применяется эндоскопия в сочетании с эндо-УЗКТ, УЗКТ, РКТ, МРТ и сцинтиграфией рецепторов соматостатина. Широкое распространение этих методов значительно облегчило диагностику данных новообразований, что может объяснять рост заболеваемости в последние годы. В диагностике НЭО большое значение имеет также изучение секретируемых ими пептидов, что делает данную группу заболеваний еще более гетерогенной (инсулинома, гастринома, глюкагонома, соматостатинома, ВИПома, нейротенсинома и др.). Хромогранин А
(ХГ-А) – вещество, секретируемое всеми нейроэндокринными клетками – служит ранним маркером НЭО органов, развившихся из клеток-производных передней и задней кишки. Самые высокие концентрации ХГ-А выявляются в метастатических опухолях из первичной средней кишки, и коррелируют с величиной опухолевой массы [3].
ВОЗ значительно усовершенствовала классификацию НЭО, которая в настоящее время учитывает локализацию, размер опухоли, врастание в кровеносные сосуды и нервные стволы, пролиферативную активность, гистологическую дифференцировку и наличие метастазов. Данная классификация основана на биологической и морфологической гетерогенности НЭО; унифицирована терминология и выделены группы опухолей с разным прогнозом: высокодифференцированные НЭО – доброкачественный характер или неопределенный потенциал злокачественности; высокодифференцированные нейроэндокринные карциномы – низкая степень злокачественности; низкодифференцированные нейроэндокринные карциномы – высокая степень злокачественности [4] (табл. № 1).
В 2006 и 2007 гг. была усовершенствована TNM-классификация данного заболевания. В настоящее время НЭО классифицируются по критериям ВОЗ, а также классификации TNM редакции 2007 г. [16] (табл. 2).
Единственным радикальным методом терапии НЭО ЖКТ и поджелудочной железы является хирургическое лечение [17]. Объем и методика хирургического вмешательства при НЭО поджелудочной железы зависят от гистологического типа и величины опухоли, её локализациии, поражения лимфатических узлов и наличия отдаленных метастазов опухоли.
Эффект химиотерапии при лечении НЭО невысокий и кратковременный. Некоторые исследователи, подчеркивая гиперваскулярный характер опухоли и метастазов, указывают на возможность использования химиоэмболизации в качестве метода выбора для лечения неоперабельных метастазов в печени.
Лечение НЭО поджелудочной железы требует мультидисциплинарного подхода. Тактика основывается на функциональной оценке опухоли, локализации первичного очага, оценке состояния лимфатических узлов, отдаленных метастазов, наличия генетических изменений и гистологического результата.
Паллиативная помощь заключается в контроле гормональных синдромов, локальной или системной циторедуктивной терапии (радиочастотная аблация (РЧА), криохирургия, трансартериальная химиоэмболизация (ТАХЭ), системная химиотерапия и радионуклидная рецепторная терапия (РРТ)).
На конференции ENETS (Европейская Ассоциация по диагностике и лечению нейроэндокринных опухолей) в 2006 году были разработаны минимально необходимые диагностические и лечебные мероприятия при НЭО поджелудочной железы [9, 10, 12, 18, 19].
Наиболее часто встречающаяся гормонально активная НЭО поджелудочной железы, часто носит доброкачественный характер (около 90%) [36]. Энуклеация инсулиномы возможна при локализации опухоли максимальным размером менее 2 см в головке поджелудочной железы без вовлечения протока. При иной локализации опухоли необходимо выполнение дистальной резекции поджелудочной железы. В случае единичной, поверхностной локализации опухоли возможна лапароскопическая операция [20]. Некоторые авторы рекомендуют при МЭН-1-синдроме выполнять энуклеацию опухоли из головки и одновременно дистальную резекцию поджелудочной железы для профилактики возникновения МЭН-1-ассоциированных опухолей [39]. Необходимость выполнения спленэктомии при хирургическом вмешательстве по поводу инсулиномы поджелудочной железы максимальным размером 2 см у пациентов с МЭН-1 остается спорной [11].
При размере опухоли более 2 см рекомендовано выполнение панкреатодуоденальных резекций или дистальных субтотальных резекций с адекватной лимфаденэктомией и спленэктомией в зависимости от показаний. При выявлении резектабельных метастазов в печени целесообразно хирургическое лечение. При нерезектабельных метастазах печени и наличии внепеченочных метастазов с целью увеличения продолжительности жизни пациентов рекомендуется проведение циторедуктивных вмешательств с применением РЧА, криохирургии, ТАХЭ, системной химиотерапии с доксорубицином и стрептозотоцином [18, 21].
Симптоматическое лечение гипогликемического синдрома предполагает диету, богатую глюкозой, и медикаментозное лечение (диазоксид, верапамил, дифенилгидантион, глюкокортикоиды). При положительном результате сцинтиграфии с соматостатиновыми рецепторами лечение аналогами соматостатина может быть также эффективно [18].
Секреторная диарея, пептические (множественные, рецидивирующие, не поддающиеся лекарственному лечению) желудочные и тонкокишечные язвы, гипертрофия складок желудка, эозофагит, гиперкальциемия – эти симптомы позволяют заподозрить синдром Золлингера–Эллисона (СЗЭ) [22]. Согласно рекомендации ENETS, биохимическая диагностика гастриномы основывается на оценке уровня сывороточного гастрина и измерении pH натощак через неделю после начала приема блокаторов протонной помпы. У пациентов с СЗЭ необходимо оценивать уровень паратгормона, кальция натощак и пролактина, что может помочь в диагностике МЭН-1-синдрома. У 5-15% пациентов с СЗЭ развиваются дополнительные гормональные нарушения (например, эктопический синдром Кушинга), что ассоциируется с худшими отдаленными результатами выживаемости [12].
Для выявления локализации опухоли используются эндоскопические методы, рентгеновская компьютерная томография (РКТ), сциниграфия рецепторов соматостатина (СРС), по возможности позитронно-эмиссинная томография (ПЭТ) с 67Ga (67Ga-DOTATOC). При недостаточной информативности этих мероприятий возможно выполнение эндоскопического УЗКТ или селективной ангиографии со стимуляцией секреции и взятием крови из воротной вены для анализа. Выявление метастазов в печени у больных гастриномой с высокой долей вероятности предполагает наличие метастазов в костях [39]. В финале диагностических процедур выполняется интраоперационное ультразвуковое исследование поджелудочной железы, дуоденоскопия. Лапароскопические операции не позволяют в полном объеме завершить диагностические манипуляции и поэтому не рекомендуются у больных с гастриномами [39].
Основной метод лечения гастриномы – хирургический. При маленьких размерах опухоли (до 2 см) рекомендуется энуклеация опухоли из головки поджелудочной железы либо иссечение при дуоденальной локализации опухоли [12]. Поскольку в 60-90% случаев гастриномы являются злокачественными новообразованиями, нерадикальный подход не оправдан. При гистологическом подтверждении злокачественной гастриномы после нерадикальной операции рекомендуется повторная радикальная резекция.
Дистальная резекция поджелудочной железы выполняется крайне редко при локализации опухоли в теле или хвосте поджелудочной железы. Наиболее часто гастриномы локализуются в «гастриномном треугольнике», образованном головкой поджелудочной железы, двенадцатиперстной кишкой и связкой Трейтца [23]. Лимфаденэктомия должна выполняться всегда в связи с тем, что возможна первичная локализация опухоли в лимфатическом узле [12]. У пациентов молодого возраста с нерезектабельными метастазами в печень возможно выполнение трансплантации печени [24].
В настоящее время перспективы хирургического лечения пациентов с синдромами МЭН-1 и Золлингера–Эллисона остаются дискутабельными. Для профилактики метастазов в печень и увеличения продолжительности жизни у некоторых групп больных оправдано проведение радикального хирургического вмешательства – гастропанкреатодуоденальной резекции (ГПДР) – на ранней стадии [25, 26]. В противоположность вышесказанному ENETS рекомендует иссечение новообразования более 2 см у больных МЭН-1-гастриномами, поскольку есть данные, подтверждающие хорошие результаты такой тактики лечения опухолей маленьких размеров [12, 13].
Лекарственное лечение гиперсекреции у пациентов с СЗЭ блокаторами протонной помпы имеет успех в 98% случаев [39]. Следовательно, продолжительность жизни больного определяется не гормональной активностью, а объемными эффектами опухоли. В лечении диссеминированной болезни рекомендовано циторедуктивное хирургическое вмешательство (при возможности удаления более 90% опухолевой ткани). Также возможно применение РЧА/ТАХЭ метастазов опухоли в печени [27, 28]. Системная химиотерапия включает комбинацию доксорубицина, стрептозотоцина и 5-фторурацила (5-ФУ) [29].
Редко встречающиеся функционирующие НЭО поджелудочной железы
Проявления специфических клинических симптомов и синдромов зависят от уровня продуцируемых опухолью специфических гормонов. Для морфологического подтверждения диагноза следует проводить иммуногистохимический анализ с хромогранином А и нейрон-специфической энолазой. Сцинтиграфия рецепторов соматостатина и ПЭТ должны быть использованы для оценки рецепторного статуса и выявления первичного очага. Для уточнения распространенности опухоли дополнительно используются УЗИ с контрастным усилением, РКТ, МРТ [10].
Хирургическое лечение рекомендуется выполнять при НЭО ПЖ и отсутствии отдаленных метастазов или наличии резектабельных метастазов в печени. При подозрении на злокачественную опухоль необходимо выполнять лимфодиссекцию [39]. Как правило, хирургическому этапу лечения должна предшествовать симптоматическая коррекция гормональной гиперсекреции. В периоперационном периоде рекомендовано использование аналогов соматостатина для исключения гормональных кризов.
Проведение паллиативного хирургического вмешательства с целью контроля уровня гормонов оправдано, если более 90% опухолевой ткани может быть удалено [10]. Трансплантацию печени можно рассматривать как вариант лечения в тех случаях, когда нет внепеченочных проявлений болезни, не выполнима резекция печени, а существующие симптомы представляют угрозу для жизни и не поддаются коррекции другими методами лечения [10]. В качестве паллиативной помощи также могут быть использованы локальные методы циторедукции: ТАХЭ, РЧА, криотерапия.
Для коррекции гиперсекреции гормонов могут быть использованы аналоги соматостатина (в 80-90% случаев ВИПом/глюкагоном симптомы заболевания сразу купируются) [10, 39]. Аналоги соматостатина могут также обладать противоопухолевым эффектом [10]. Пациентам с ВИПомами, не реагирующими на лечение аналогами самотостатина, могут быть назначены препараты интерферона альфа.
При прогрессировании заболевания рекомендуется системная химиотерапия, включающая стрептозоцин и 5-ФУ с доксорубицином или без него [10].
При НЭО с высокой экспрессией рецепторов соматостатина может быть успешной полипептидная радионуклидная рецепторная терапия (ПРРТ), однако этот метод остается экспериментальным до появления результатов клинических исследований.
Высокодифференцированные нефункционирующие НЭО ПЖ
Нефункционирующие НЭО ПЖ, в отличие от функционирующих, часто диагностируются на поздних стадиях болезни из-за отсутствия клинической симптоматики. Как правило, клиническая манифестация обусловлена размером самой опухоли, первичная опухоль легко определяется инструментальными методами. Таким больным рекомендуется обязательное проведение сцинтиграфии рецепторов соматостатина для уточнения рецепторного статуса опухоли и распространенности болезни. В качестве сывороточных маркеров опухоли исследуют хромогранин А и панкреатический полипептид (ПП). В некоторых случаях рекомендовано генетическое исследование для исключения синдрома МЭН-1 [9].
Хирургическое лечение случайно выявленных нефункционирующих НЭО ПЖ выполняется при отсутствии отдаленных метастазов опухоли или наличии операбельных метастазов в печени. При размерах первичной опухоли менее 2 см возможно выполнение энуклеации новообразования, при больших размерах очага выполняется резекция поджелудочной железы с адекватной лимфодиссекцией [9]. После энуклеации опухоли с последующим гистологическим подтверждением злокачественной природы образования необходимо выполнить повторную радикальную операцию [9, 39].
При нерезектабельных метастазах в печени возможно выполнение трансплантации печени, однако к такому назначению нужно подходить крайне избирательно. Рецидивы в течение месяца после трансплантации печени могут быть связаны с наличием не выявленных внепеченочных метастазов опухоли [24].
При лечении пациентов с МЭН-1 объемы хирургического вмешательства остаются дискутабельными. По мнению Creutzfeldt и соавт., операция должна быть завершена энуклеацией очагов, даже если их размер составляет более 2 см; другие же авторы рекомендуют проводить энуклеацию опухоли из головки ПЖ и профилактически дистальную субтотальную (80%) панкреатэктомию [7, 14, 30, 40].
Проведение паллиативной резекции печени оправдано при удалении более 90% опухолевой ткани, но противопоказано, если первичная опухоль признана нерезектабельной. Исключением являются те случаи, когда резекция печени является единственным способом устранения осложнений, обусловленных наличием метастазов в печени [9].
ЕNETS рекомендует алгоритм хирургического ведения пациентов с нефункционирующими НЭО ПЖ с метастазами в печень [9] (рис. 1).
Методы локорегионарного лечения (ТАХЭ, РЧА) рекомендуются только у пациентов с отсутствием внепеченочных метастазов, однако завершенных клинических исследований о влиянии данных методов на выживаемость в настоящее время нет [39]. Первой линией биотерапии для пациентов с положительными соматостатиновыми рецепторами в опухоли являются аналоги соматостатина. При неэффективности биотерапии должна быть назначена системная химиотерапия стрептозотоцином в комбинации с 5-ФУ и доксорубицином. До настоящего времени нет данных, позволяющих рекомендовать адьювантную терапию [9].
Низкодифференцированные НЭО поджелудочной железы
Низкодифференцированные НЭО поджелудочной железы характеризуются агрессивным биологическим потенциалом опухоли, отсутствием рецепторов к самотостатину, плохим прогнозом. Информативным онкомаркером этих опухолей является нейронспецифическая энолаза, тогда как уровень хромогранина А может не выявляться. Стандартное инструментальное обследование обычно позволяет выявить первичную опухоль и метастазы в печени. Диагностической процедурой, позволяющей уточнить распространенность опухоли, может служить ПЭТ с 18F-фтордезоксиглюкозой. С помощью чрескожной биопсии опухоли гистологически подтверждается диагноз и определяется лечебная тактика. Хирургическое лечение рекомендовано только для первично резектабельных опухолей, при выявлении метастазов в печени оперативное вмешательство не показано. Циторедуктивные операции при диссеминированной болезни не рекомендуются, хотя у некоторых пациентов может быть оправдано проведение ТАХЭ. Больным с диссеминированной опухолью показана системная химиотерапия с включением этопозида и цисплатина. Ответ на проводимое лечение получают у 55-80% пациентов, а продолжительность эффекта составляет 8-11 месяцев [19, 37].