Невральные структуры что это
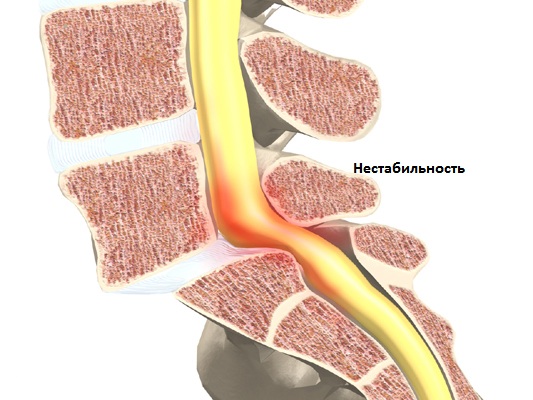
Нестабильность позвоночно-двигательного сегмента
Нестабильность позвоночно-двигательного сегмента
ПДС комплектуется из двух позвонков, которые соединены друг с другом диском, связками, мышцами (особенное значение имеет межпозвонковый диск, позволяющий амортизировать нагрузки и удары ). Фасеточные суставы позволяют иметь определенный диапазон движений между позвонками. В боковых отделах позвоночного сегмента через фораминальные отверстия проходят кровеносные сосуды и нервные корешки. Двигательные свойства позвоночника зависят от деятельности множества ПДС.
Симптомы
Симптомы зависят как от локализации нестабильности ПДС, так и степени воздействия на невральные структуры. При нестабильности в шейном отделе позвоночника основным симптомом является боль в шее, которая усиливается при физической нагрузке. Причиной болевого синдрома является перенапряжение мышц шеи, вследствие этого возникает мышечный спазм, ухудшается микроциркуляция и тонус в мышцах.Вследствие этого со временем у человека снижается возможность выполнять обычные физические нагрузки. По мере прогрессирования нестабильности и развития стеноза спинномозгового канала возникает воздействие на спинной мозг и нервные структуры и могут появиться следующие осложнения:
Диагностика
Лечение.
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
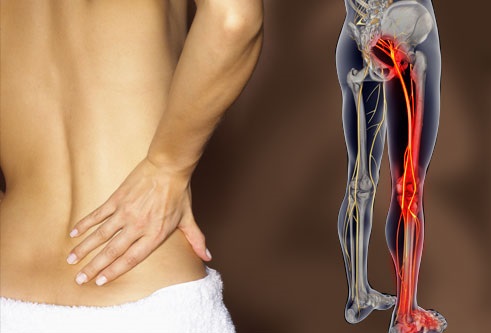
Корешковый синдром поясничного отдела
Причины
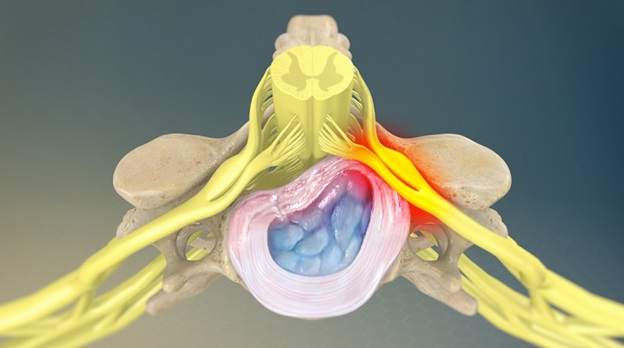
Любые морфологические образования или патологические процессы, которые приводят к компрессионному воздействию на нервный корешок, могут стать причиной корешкового синдрома.
Основными причинами поясничной радикулопатии являются:
У пациентов моложе 50 лет наиболее частой причиной корешкового синдрома в поясничном отделе позвоночника является грыжа межпозвоночного диска. После 50 лет корешковая боль часто вызвана дегенеративными изменениями позвоночника (стеноз межпозвоночного отверстия).
Факторы риска развития поясничной радикулопатии:
Симптомы
Симптомы, возникающие в результате корешкового синдрома (радикулопатии), локализуются в зоне иннервации конкретного корешка.
Паттерны боли
Начало появления симптомов у пациентов с пояснично-крестцовой радикулопатией (корешковым синдромом) часто бывает внезапным и включает боль в пояснице.
Сидение, кашель или чихание могут усугубить боль, которая распространяется от ягодицы по задней поверхности голени, лодыжки или стопы.
Необходимо быть бдительным при наличии определенных симптомов (красных флажков). Такие красные флажки могут означать более тяжелое состояние, требующее дальнейшего обследования и лечения (например, опухоль, инфекция). Наличие лихорадки, потери веса или ознобов требует тщательного обследования.
Возраст пациента также является фактором при поиске других возможных причин симптоматики у пациента. Лица моложе 20 лет и старше 50 лет подвержены повышенному риску возникновения более серьезных причин боли (например, опухоли, инфекции).
Диагностика
Первичный диагноз корешкового синдрома пояснично-крестцового отдела позвоночника выставляется на основании симптоматики истории болезни и данных физического обследования (включая тщательное изучение неврологического статуса). Тщательный анализ моторной, сенсорной и рефлекторной функций позволяет определить уровень поражения нервного корешка.
Если пациент сообщает о типичной односторонней иррадиирущей боли в ноге и есть один или несколько положительных результатов неврологического теста, то тогда диагноз радикулопатии очень вероятен.
Тем не менее, существует ряд состояний, которые могут проявляться схожими симптомами. Дифференциальную диагностику необходимо проводить со следующими состояниями:
Для постановки клинически достоверного диагноза, как правило, требуются инструментальные методы диагностики:
Лечение
Лечение корешкового синдрома пояснично-крестцового отдела позвоночника будет зависеть от тяжести симптоматики и клинических проявлений. Чаще всего, используется консервативное лечение, но в определенных случаях бывает необходимо хирургическое лечение.
Консервативное лечение:
Иглорефлексотерапия. Этот метод широко используется в лечении корешкового синдрома в пояснично-крестцовом отделе позвоночника и помогает как снизить симптоматику в остром периоде, так и входит в комплекс реабилитации.
Хирургическое лечение
Оперативные методы лечения корешкового синдрома в пояснично-крестцовом отделе позвоночника необходимы в тех случаях, когда есть устойчивость к консервативному лечению или имеются симптомы, свидетельствующие о выраженной компрессии корешка такие как:
Некоторые хирургические процедуры, используемые для лечения поясничной радикулопатии:
Прогноз
В большинстве случаев удается лечить корешковый синдром в пояснично-крестцовом отделе позвоночника консервативно (без хирургического вмешательства) и восстановить трудоспособность. Продолжительность лечения может варьироваться от 4 до 12 недель в зависимости от тяжести симптомов. Пациентам обязательно необходимо продолжать в домашних условиях выполнять упражнения для улучшения осанки, а также на растяжение, усиление и стабилизацию. Эти упражнения необходимы для лечения состояния, вызвавшего корешковый синдром.
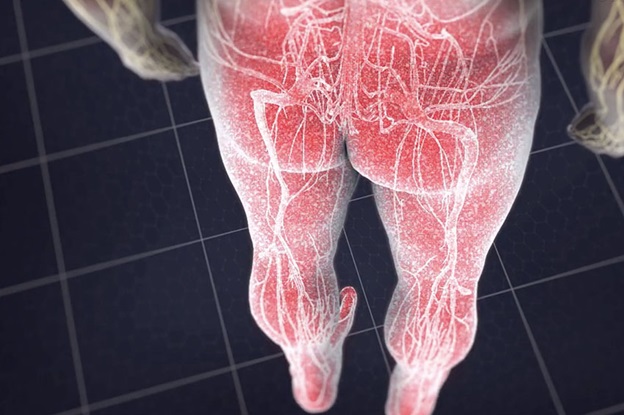
Периферическая нейропатия нерва
Периферическая нейропатия нерва
При наиболее распространенных формах полинейропатии, нервные волокна наиболее удаленные от мозга начинают дисфункционировать в первую очередь. Боль и другие симптомы часто появляются симметрично, например, в обеих ногах, сопровождаемых постепенным прогрессией в обеих ногах. Иногда повреждаются пальцы рук и руки с прогрессированием выше к середине тела. У многих пациентов с диабетической нейропатией- именно такая форма прогрессирования и повреждения нервов.
Классификация периферических невропатий
Существует более 100 типов периферической невропатии, которые были идентифицированы, каждый с характерным симптомокомплексом структурой развития, и прогнозом. Нарушенная функция и симптомы зависят от типа нервов, которые подверглись повреждению (моторные, сенсорные, или вегетативные). Двигательные нервы управляют движениями всех мышц под контролем сознания, такими как ходьба, хватание или речь. Сенсорные нервы передают информацию о процессах восприятия, таких как тактильное чувство или боль вследствие пореза. Пучки вегетативных нервных волокон регулируют биологические действия, которыми выполняются без сознательно, такие как дыхание, переваривание пищи, деятельность сердца или желез секреции. Хотя некоторые невропатии могут оказать влияние на все три типа нервов, чаще всего происходит нарушение функции одного или двух типов нервов. Поэтому, врачи могут использовать термин, такой как преобладающе моторная невропатия, преимущественно сенсорная невропатия, сенсорно-моторная невропатия, или автономная невропатия.
Симптомы и причины
Сенсорное повреждение нервов вызывает более широкий диапазон симптомов, потому что у сенсорных нервов существует целая группа узкоспециализированных функций. Большие сенсорные волокна окружены миелиновой оболочкой и регистрируют вибрацию тактильные ощущения и проприорецепцию. Повреждение больших сенсорных волокон снижает способность чувствовать колебания и прикосновение что в результате дает онемение, особенно в руках и ногах. Люди могут чувствовать ощущения надетых перчаток или чулков. Многие пациенты не различают по прикосновению размер предмета или его форму. Это повреждение сенсорных волокон может способствовать потере рефлексов (также как и при повреждении моторных нервов). Потеря проприорецепции (чувство положения тела в пространстве) усложняет возможность координировать сложные движения или устойчивость с закрытыми глазами. Невропатической болью трудно поддается лечению и может оказывать серьезное влияние на эмоциональное состояние и общее качество жизни. Невропатическая боль часто усиливается ночью, серьезно нарушая сон, что еще больше ведет к эмоциональному дискомфорту.
Травматическое повреждение является наиболее распространенной причиной повреждения нерва. Ранение или бытовая травма, от автокатастроф, падений, или связанных с занятиями спортом может привести к разволокнению нервов компрессии нервов растяжению или полному отрыву от спинного мозга. Даже не очень сильные травмы также могут вызвать серьезное повреждение нервов. Сломанные или вывихнувшиеся кости могут оказывать повреждающее давление на соседние нервы, и также при грыжах диска может возникать компрессия нервных корешков.
Гормональные дисбалансы могут изменить нормальные метаболические процессы и вызвать невропатии. Например, недостаток гормонов щитовидной железы замедляет метаболизм, приводя к задержке жидкости и отеку тканей, которые могут оказывать давление на периферические нервы. Избыточная выработка соматотропина может привести к акромегалии, состояние, характеризующееся патологическим увеличением многих частей скелета, включая суставы. Нервы, снабжающие эти измененные суставы, часто тоже повреждаются.
Дефициты витамина и хронический алкоголизм могут вызвать необратимые повреждения тканей нерва. Витамины. Витамины Е, B1, B6, B12, и никотиновая кислота очень важны для нормальной функции нервов. Дефицит тиамина, в частности распространен у людей с хроническим алкоголизмом, потому что у этих людей нарушено поступление тиамина с пищей. Дефицит тиамина может вызвать достаточно болезненную невропатию конечностей. Некоторые исследователи полагают, что чрезмерное употребление алкоголя может, само по себе, способствовать непосредственному повреждению нервов, что называются алкогольной невропатией. Сосудистые заболевания и болезни крови могут уменьшить доставку кислорода к периферическим нервам и быстро привести к серьезному повреждению или гибели тканей нерва (к примеру, острая гипоксия мозга приводит к инсульту). Диабет часто приводит к сужению кровеносного сосуда. Различные формы васкулита часто приводят к утолщению стенки сосуда и уменьшения диаметра сосудов за счет рубцовой ткани. Эту категорию повреждения нервов, в котором повреждены изолированные нервы в различных областях, называют мультифокальная мононевропатией.
Заболевания соединительной ткани и хроническое воспаление могут вызвать прямое или косвенное повреждение нервов. Когда окружающие нервы слои тканей находятся в длительном воспалительном процессе, то воспаление может затронуть и непосредственно волокна нерва. Хроническое воспаление также приводит к прогрессивной деструкции соединительной ткани, подвергая волокна нерва, большему риску компрессии и инфицирования. Суставы при воспалении могут отекать и вовлекать нервы, причиняя боль.
Рак и доброкачественные опухоли могут прорастать и оказывать деструктивное действие на нервы. Опухоли также могут образоваться непосредственно из клеток ткани нерва. Достаточно нередко полинейропатия связана с нейрофиброматозом, генетическим заболеваниям, при котором происходит образование множественных доброкачественных опухолей из тканей нерва. Формирование невромы может быть одним элементом из регионального болевого синдрома или синдромом симпатической рефлекторной дистрофии, который может быть вызван травматическими причинами или хирургической травмой. Паранеопластический синдром, группа редких дегенеративных нарушений, которые вызваны реакцией иммунной системы человека на злокачественную опухоль, также может косвенно вызвать множественное повреждение нервов. Повторное стрессовое воздействие часто приводит к компрессионным невропатиям. Кумулятивное повреждение может появиться вследствие повторных чрезмерных движений, которые требуют сгибания любой группы суставов в течение длительного периода времени. В результате таких движений может возникнуть воспаление и отек сухожилия и мышц что может привести к сужению каналов через которые проходят некоторые нервы. Такие повреждения нередки во время беременности, вероятно, потому что увеличение веса и задержка жидкости также сужают каналы нервов.
Токсические вещества могут также вызвать повреждение периферических нервов. У люди, которые подверглись воздействию тяжелых металлов (мышьяк, свинец, ртуть, таллий), производственных токсинов, или экологических токсинов часто развиваются невропатии. У определенных препаратов для лечения от рака, противосудорожных препаратов, противовирусных средств, антибиотиков есть побочные эффекты, которые могут включать повреждение периферических нервов, что иногда является протипоказанием для их длительного применения.
Инфекции и аутоиммунные нарушения могут вызвать периферическую невропатию. Вирусы и бактерии, которые могут воздействовать на ткани нерва, включают опоясывающий лишай, вирус Эпштейн-Барра, вирус цитомегалии, и другие разновидности вирусов герпеса. Эти вирусы избирательно повреждают сенсорные нервы, вызывая приступообразные острые боли. Постгерпетическая невралгия часто встречается после эпизода опоясывающего лишая и может быть очень болезненной.
Вирус иммунодефицита человека (ВИЧ), также вызывает значительное повреждение в центральной и периферической нервной системе. Вирус может вызвать несколько различных форм невропатии, каждая из которых четко связана с определенной стадией иммунодефицита. Быстро прогрессирующая, болезненная полинейропатия, с вовлечением рук и ног, часто является первым клиническим симптомом ВИЧ-инфекции.
Вирусные и бактериальные инфекции могут также вызвать вторичное повреждение нервов, способствую возникновению вызывая аутоиммунных нарушений, при которых происходит агрессия иммунной системы против собственных тканей. Аутоиммунные процессы, как правило, вызывают деструкцию миелиновых оболочек нервов или аксонов (волокон нерва).
Диагностика
Диагностирование периферической невропатии подчас бывает трудным, в связи с вариабельностью симптомов. Нередко требуется полное неврологическое обследование, включая: симптомы пациента, профессию, социальные привычки, наличие любых токсинов, наличие хронического алкоголизма, возможность наличия ВИЧ или другой инфекционной болезни, и наличие в анамнезе родственников с невропатией, проведение анализов, которые могут идентифицировать причину невропатии, и проведение обследований позволяющих определить степень и тип повреждения нервов.
Общее обследование тесты и анализы могут выявить наличие повреждения нервов вследствие системного заболевания. Анализы крови могут диагностировать диабет, дефицит витаминов, печеночную или почечную недостаточность, другие нарушения обмена веществ, и признаки патологической активности иммунной системы. Экспертиза цереброспинальной жидкости, которая циркулирует в головном и спинном мозге, может выявить патологические антитела, связанные с невропатией. Более узкоспециализированные анализы могут выявить болезни крови или сердечнососудистые заболевания, заболевания соединительных тканей, или злокачественные образования. Тесты на мышечную силу выявление признаком судорожной активности мышц или фасцикуляций могут указывать на повреждение моторных нейронов. Оценка способности пациента восприятия вибрации, мягкого прикосновения, положение тела (проприорецепция), температурную и болевую чувствительность помогает определить повреждение сенсорных волокон как больших, так и малых сенсорных волокон. На основе результатов неврологического осмотра, физического осмотра, подробной истории заболевания может быть назначены дополнительные тесты и обследования для уточнения диагноза.
Компьютерная томография, является атравматичным, безболезненным исследованием, которое дает возможность визуализировать органы костные мягкие ткани. Компьютерной томографии может выявить костные или сосудистые изменения опухоли головного мозга кисты грыжи межпозвоночного диска, энцефалит, спинальный стеноз (сужение спинномозгового канала), и другие нарушения.
Магнитно-резонансная томография (ЯМР или МРТ) может исследовать состояние мышцы ее размер, выявить замену ткани мышцы жировой тканью, и определить, было ли компрессионное воздействие на нервное волокно. Аппараты МРТ создают сильное магнитное поле вокруг тела. Радиоволны проходят через тело и вызывают резонанс, который может быть фиксирован под различными углами в пределах тела. Компьютер обрабатывает этот резонансный эффект и преобразует в трехмерное изображение.
Лечение
Методов лечения наследственных периферических невропатий не существует. Однако есть методы лечения для многих других форм. Вначале проводится лечение причины заболевания и проводится симптоматическое лечение. У периферических нервов есть способность регенерировать, в том случае если сохранена сама нервная клетка. Симптоматику можно нивелировать, и устранение причин определенных форм невропатии часто может предотвратить повторное повреждение.
Системные заболевания часто требуют более комплексного лечения. Строгий контроль над уровнем глюкозы в крови, как показали исследования, уменьшает нейропатические симптомы и помогает пациентам с диабетической невропатией избежать дальнейшего повреждения нервов. Воспалительные и аутоиммунные заболевания, приводящие к невропатии, можно лечить несколькими способами. Иммунодепрессанты, такие как преднизон, циклоспорин, или имуран могут быть очень эффективными. Процедура плазмофереза, при которой происходит очистка крови от иммунных клеток и антител, может уменьшить воспаление или подавить активность иммунной системы. Большие дозы иммуноглобулинов, которые функционируют как антитела, также могут подавить патологическую активность иммунной системы. Но невропатическая боль трудно поддается лечению. Умеренная боль может иногда облегчаться анальгезирующими средствами. Некоторые препараты (применяемые для лечения других заболеваний) оказались полезными для многих пациентов, страдающих от тяжелых форм хронической невропатической боли. Они включают Мексилитин, лекарство, созданное для лечения нарушения сердечного ритма (но иногда вызывающее выраженные побочные действия); некоторые противоэпилептические средства, включая габапентин, фенитоин, и карбамазепин; и некоторые виды антидепрессантов, включая трициклические, такие как амитриптилин. Инъекции местных анестетиков, таких как лидокаин или использование пластырей, содержащие лидокаин, могут облегчить сильную боль. В самых тяжелых случаях болей можно хирургически разрушить нервы; однако, результаты являются подчас временными, и процедура может привести к осложнениям.
Ортопедические изделия могут помочь уменьшить боль и уменьшить воздействие физической инвалидности. Различные ортезы для руки или ноги могут компенсировать слабость мышцы или уменьшить компрессию нерва. Ортопедическая обувь может улучшить нарушения походки, и помочь предотвратить травмы стопы у людей со снижением восприятия боли.
Хирургическое вмешательство часто может обеспечить непосредственное облегчение при мононейропатиях, вызванных ущемлением нерва или компрессией. Удаление грыжи диска вызывает декомпрессию корешка. При удалении опухолей тоже уменьшается воздействие опухолевой ткани на нервы. Кроме того, декомпрессия нерва может быть достигнута с помощью релизинга связок и сухожилий.
Хирургическое лечение невралгии тройничного нерва
Полиэтиологичный генез болевого синдрома, затрудняющий курацию пациентки.
Пациентка Ш., 63 года, поступила в 1 неврологическое отделение 07.06.2015.
Жалобы при поступлении на приступообразные жгучие, высокой интенсивности боли в области правой щеки, подбородка, уха справа, в области верхних и нижних зубов, боли в височно-нижнечелюстном суставе справа, с усилением во время разговора, приема пищи (пережевывания), умывания, с периодическими нарастаниями болевого синдрома в форме «прострелов», гиперсаливацию (больше по ночам), ухудшение ночного сна из-за болей.
Анамнез: В 2011 г. весной впервые появились нейропатические боли в зонах иинервации II и III ветви правого тройничного нерва. Проводилось лечение, включавшее курс финлепсина и лирики, а также были начаты процедуры ИРТ и магнитотерапия, которые отменены после выявления на МРТ фалькс-менингеомы в лобной области. Болевой синдром регрессировал в течение 3-х месяцев.
Длительное время в 2014 г. занималась протезированием зубов.
Эта статья.
. про отделения
Читайте также
Ограничения в связи с профилактикой распространения коронавирусной инфекции COVID-19
Госпитализация (круглосуточно)
8 (499) 394-67-57
Скорая помощь (круглосуточно)
8 (495) 620-84-04
8 (499) 390-80-84
Невральные структуры что это
Актуальность применения методов интраоперационной визуализации в хирургии дегенеративных заболеваний поясничного отдела позвоночника обусловлена нередкими случаями недостаточной хирургической декомпрессии невральных структур и ятрогенной травмы нервного корешка и дурального мешка. Этому могут способствовать плохая ориентация хирурга в интраоперационной анатомии и сложность контроля радикальности декомпрессии невральных структур [1—6].
По сравнению с такими методами интраоперационной визуализации, применяемыми в спинальной хирургии, как интраоперационные МРТ и КТ, использование интраоперационного ультразвукового исследования (ИОУЗИ) в практическом отношении представляется наиболее актуальным в первую очередь в связи с его большей доступностью. ИОУЗИ является простым в освоении и использовании, безвредным, недорогим и широкодоступным методом интраоперационной визуализации в реальном времени, данные которого могут быть сопоставимы с данными интраоперационных КТ и МРТ, а порой и превосходить их [7—9].
Аналогично применению ИОУЗИ в хирургии головного мозга его эффективное использование возможно и в спинальной хирургии, в частности в хирургии дегенеративных заболеваний поясничного отдела позвоночника. Метод ИОУЗИ не теряет своей актуальности и продолжает развиваться. Он привлекает внимание врачей различных специальностей — неврологов, анестезиологов, хирургов, нейрохирургов и др. В российской и зарубежной литературе не много научных работ, посвященных применению ИОУЗИ в спинальной хирургии, и единичные зарубежные статьи по использованию ИОУЗИ в хирургии дегенеративных заболеваний поясничного отдела позвоночника [10, 11].
Цель исследования — изучение возможностей применения ИОУЗИ при поясничной микродискэктомии.
Материал и методы
Исследование проводили на базе нейрохирургического отделения РНЦХ им. акад. Б.В. Петровского. В него включены 48 пациентов (23 (48%) женщины и 25 (52%) мужчин в возрасте от 23 до 80 лет, средний возраст 48,5 года), проходивших хирургическое лечение по поводу грыжи дисков поясничного отдела позвоночника с использованием ИОУЗИ в 2014—2017 гг.
Анализ распределения пациентов по уровню поражения и количеству оперированных позвоночно-двигательных сегментов показал, что в группе пациентов с грыжами дисков операции на уровне LII—LIII произведены у 1 (2%) пациента, на уровне LIII—LIV — у 2 (4%) пациентов, на уровне LIV—LV — у 25 (52%) пациентов, на уровне LV—SI — у 19 (40%) пациентов, на 2 уровнях — у 1 (2%) пациента.
Неврологический и функциональный статусы пациентов оценивали перед операцией, в течение стационарного периода лечения, через 3 и 12 мес после операции. В предоперационном периоде с целью определения метода хирургического лечения и планирования операции изучали данные функциональных рентгенограмм, КТ и МРТ поясничного отдела позвоночника при поступлении, для оценки полученного результата — через 3 и 12 мес. При оценке состояния пациентов использовали визуально-аналоговую шкалу (ВАШ) корешковой боли, шкалу Карновского и опросник Oswestry.
ИОУЗИ выполняли на этапах до и после флавотомии для уточнения особенностей интраоперационной анатомии, оптимизации хирургического доступа к субстрату компрессии невральных структур и после декомпрессии невральных структур для контроля радикальности проведенной декомпрессии. Исследуя возможности ИОУЗИ и оптимизируя технологию хирургии с использованием УЗИ, мы стремились удовлетворить потребность хирурга в данных интраоперационной нейровизуализации, помогающих лучше ориентироваться в интраоперационной анатомии, и сделать эту технологию простой и удобной.
В исследование были включены пациенты с грыжей дисков поясничного отдела, которым проводили одно- или двусторонний междужковый доступ на одном или нескольких уровнях.
Критерии включения в исследование: возраст от 18 лет до 80 лет, некупируемый корешковый болевой синдром в течение более 4 нед и/или наличие неврологического дефицита, грыжа диска центральной, парамедианной и фораминальной локализации, рецидив грыжи диска.
Критерии исключения: возраст до 18 лет и после 80 лет, некомпрессионная радикулопатия, грыжа диска экстрафораминальной локализации, грубый латеральный фораминальный стеноз позвоночного канала, отягощенный соматический анамнез и наличие абсолютных противопоказаний к плановому хирургическому лечению.
Техника хирургии не отличалась от современной классической техники и соответствовала принципам микрохирургии и мини-инвазивности. На операции использовали монополярную и биполярную коагуляцию, нейрохирургический бор, операционный микроскоп, микрохирургические инструменты, костные кусачки и конхотомы. Всегда применяли активное дренирование послеоперационной раны в 1-е сутки, внутрикожный косметический шов. У 28 (58,3%) пациентов выполнена динамическая межостистая фиксация имплантами Stenofix (DePuy Synthes, США) (рис. 1). 
Показаниями к динамической межостистой фиксации считали:
— подтвержденный радиологическими методами исследований и клинически значимый стеноз позвоночного канала на одном или двух уровнях от LI до SI;
— грыжу диска на широком основании со снижением высоты задних отделов диска;
— сочетание грыжи диска с центральным и/или латеральным субартикулярным стенозом позвоночного канала;
— сочетание грыжи диска с дегенеративным стабильным спондилолистезом до I стадии.
Практически все современные аппараты УЗИ дают возможность хорошей визуализации и применимы для исследования различных тканей поясничной области. Мы использовали аппараты УЗИ BK Medical Pro Focus 2202 и BK Medical Flex Focus 400 (Дания) (рис. 2). 
При выборе датчика для ИОУЗИ принципиальными условиями являлись возможность погрузить датчик в рану, не увеличивая кожного разреза, и хорошее качество визуализации, достаточное для уверенного дифференцирования различных тканей. Из множества апробированных датчиков мы выбрали нейрохирургические датчики Craniotomy 8862 и Burr-Hole 8863 (рис. 3). 
Нейрохирургические датчики Craniotomy 8862 и Burr-Hole 8863 адаптированы для нейрохирургии и имеют специальное программное обеспечение, улучшающее качество изображения. Датчик Craniotomy 8862 работает на частотах 10—3,8 MГц, размер сканирующей поверхности — 29×10 мм. Он оказался универсальным, потому что его можно было использовать интраоперационно, до или после операции, в том числе на операции как при двустороннем, так и при одностороннем междужковом доступе. При применении датчика Craniotomy 8862 качество изображения лучше, чем с датчиком Burr-Hole 8863 (10—3,8 MГц, размер сканирующей поверхности — 10×8,6 мм). Последний полезен при микродискэктомии с односторонним междужковым доступом с малым (3 см) разрезом, поскольку его размер позволяет ввести его с узкую рану и сканировать с уровня междужкового промежутка, что улучшает качество визуализации.
Для соблюдения условий асептики на операции датчик погружали в стерильную латексную перчатку, заполняя пространство между поверхностями датчика и латексом звукопроницаемым гелем. Шнур датчика погружали в стерильный чехол. При сканировании в аксиальной плоскости датчик ориентировали так, чтобы сторона изображения на мониторе УЗИ соответствовала той же стороне у пациента. При сканировании в сагиттальных плоскостях датчик поворачивали на 90° против часовой стрелки, при этом левая половина скана УЗИ соответствовала каудальной стороне пациента. После осуществления гемостаза рану заполняли стерильным физиологическим раствором и проводили сканирование с поверхности жидкости. Соблюдали осторожность при погружении датчика в рану, чтобы не повредить чехол датчика о костные структуры и ранорасширитель и избежать нарушения стерильности операционной раны.
Сканирование проводили как в стандартных плоскостях (сагиттальная, аксиальная), что позволяло воспринимать данные ИОУЗИ как данные МРТ (рис. 4), 
С помощью ИОУЗИ идентифицировали следующие анатомические структуры и ткани: остистые отростки, межпозвоночные суставы, желтую связку, эпидуральный жир, эпидуральные вены, твердую мозговую оболочку, ликворные пространства, спинномозговые корешки, задние отделы фиброзного кольца, грыжу диска, секвестр грыжи диска, синовиальную кисту межпозвоночного сустава, эпидуральные рубцы, задние поверхности тел смежных позвонков, пульпозное ядро. Определяли размеры дурального мешка, отходящих на данном уровне корешков, грыжи диска, высоту задних отделов диска. При сканировании в сагиттальной плоскости уточняли степень смещения тел позвонков у пациентов со спондилолистезом. Измеряли расстояния от поверхности датчика до различных структур. Оценивали форму дурального мешка и отходящих от него спинномозговых корешков. Отмечали степень пульсации дурального мешка, выраженность свободных ликворных пространств в нем. При выполнении ИОУЗИ анализировали качество визуализации.
Результаты и обсуждение
В ходе проведения хирургической операции ИОУЗИ выполняли на следующих этапах: до флавотомии, после флавотомии в ходе декомпрессии невральных структур и после декомпрессии. При разработке методики ИОУЗИ ориентировались на практические потребности хирурга. На каждом этапе хирургической операции ИОУЗИ помогает решать строго определенные задачи, характерные для данного этапа. Информация о месторасположении субстрата компрессии, полученная хирургом до флавотомии, позволяет оптимизировать объем и форму флавотомии, аркотомии и медиальной фасетотомии, что на последующих этапах хирургической операции значительно облегчает все действия хирурга. После доступа к невральным структурам и субстрату компрессии хирург старается получить информацию об их взаиморасположении, форме и размерах с помощью микроскопии и пальпации инструментом. ИОУЗИ дополняет эту информацию высокоинформативными данными, сопоставимыми с данными МРТ или К.Т. Эта информация позволяет при доступе к субстрату компрессии и его удалении избежать излишней травмы невральных структур и эпидуральных вен, сократить время выполнения этого этапа операции и кровопотерю. На этапе ревизии после декомпрессии невральных структур у хирурга нередко возникают сомнения в ее радикальности, например в случаях с большими секвестрами, со срединными циркулярными грыжами дисков или при рубцово-спаечном процессе во время ревизионной хирургии. В таких ситуациях подвижность невральных структур ограниченна, а их внешний вид и плотность изменены, что значительно затрудняет ревизию. ИОУЗИ позволяет убедиться в адекватности декомпрессии, а при обнаружении фактора компрессии — локализовать и удалить его. Таким образом, ИОУЗИ выполняется по этапам, хотя сканирование легко и быстро можно провести в любой момент операции.
Длительность ИОУЗИ в ходе проведения хирургических операций в нашем исследовании составляла от 1 до 10 мин. Прослеживалась тенденция к постепенному уменьшению длительности ИОУЗИ по мере накопления опыта сканирования. Средняя продолжительность ИОУЗИ составила 6 мин.
Столб жидкости, желтая связка и ликвор, находящийся в дуральном мешке, — хорошо узнаваемые ориентиры при интерпретации данных ИОУЗИ. В аксиальной плоскости сканирования, глубже столба жидкости, хорошо контурируется угловидной формы гипоэхогенная желтая связка, а по краям от нее ультразвук отражается от поверхности межпозвоночных суставов в виде максимально гиперэхогенных, горизонтально расположенных линий с гипоэхогенной акустической тенью за ними. Под желтой связкой визуализируется округлой формы дуральный мешок с анэхогенным ликвором внутри него. Между дуральным мешком и желтой связкой виден гиперэхогенный, обычно треугольной формы эпидуральный жир заднего эпидурального пространства. Под дуральным мешком можно увидеть гипоинтенсивную, обычно полукруглой формы грыжу диска, которая задним своим краем деформирует передний край дурального мешка. Значительно гиперэхогенная горизонтальная линия от поверхности тела позвонка, расположенная глубже дурального мешка и грыжи, ограничивает позвоночный канал сзади. Сканирование в сагиттальной плоскости дополняло основную информацию, полученную при сканировании в аксиальной плоскости. Таким образом, хорошо визуализируются столб жидкости, желтая связка и задние поверхности межпозвоночных суставов, эпидуральный жир, дуральный мешок с ликвором, грыжа диска, задний край тела позвонка (рис. 5). 
На этом этапе хирург в ходе исследования получает информацию о форме и толщине желтой связки, наличии под ней эпидурального жира, форме и степени компрессии дурального мешка. Эта информация помогает лучше ориентироваться в интраоперационной анатомии и выбрать оптимальное место для безопасного вскрытия желтой связки. Визуализация и оценка размеров, формы и локализации грыжи диска способствуют планированию объема флавотомии, аркотомии и медиальной фасетотомии и коррекции их размера в ходе их выполнения. В свою очередь, выполнение оптимального доступа к грыже диска до начала ревизии структур позвоночного канала позволяет избежать излишней или недостаточной флавотомии и аркотомии, облегчает поиск грыжи и смещение дурального мешка с компримированным нервным корешком, что уменьшает кровопотерю, длительность и травматичность операции.
При интерпретации сонограмм на этом этапе легко узнаваемой структурой является дуральный мешок, содержащий эхонегативный ликвор и умеренно гиперэхогенные корешки, а их пульсация значительно упрощает идентификацию. Поэтому мы рекомендуем ориентироваться на данные ИОУЗИ как на данные миелографии или данные МРТ в режиме миелографии. Правильной пространственной ориентации также может помочь верификация эпидуральных вен в режиме цветного доплеровского картирования. По форме и размеру дурального мешка, степени его пульсации, выраженности свободных ликворных пространств в нем можно судить о его компрессии и локализовать компримирующий субстрат (рис. 6). 
У пациентов, которым проведен односторонний междужковый хирургический доступ, качество визуализации было хуже, чем у пациентов, которым выполнили двусторонний междужковый доступ, в связи с меньшим размером акустического окна (рис. 7). 
После декомпрессии невральных структур качество ультразвуковой визуализации у всех пациентов улучшилось. Это связано с тем, что после декомпрессии тканей и структур позвоночного канала они расправляются и начинают занимать правильное анатомическое положение, появляется граница между ними. В результате значительно улучшается контрастность изображения сканов ИОУЗИ и облегчается интерпретация полученных данных. Во время сканирования исследователь видит живую картину: твердая мозговая оболочка расправленного дурального мешка активно пульсирует, а нервные корешки, свободно плавающие в ликворе, совершают волнообразные движения. Следует учитывать, что зона сканирования ограничена размерами и формой акустического окна, сформированного выполненным хирургическим доступом. Доступная для хирургической ревизии и прямого осмотра зона, как правило, доступна и для сканирования. Она обычно занимает область позвоночного канала на протяжении диска и соседних с ним четвертей смежных тел позвонков. Таким образом, субстрат компрессии, находящийся вне указанной зоны, не будет доступен ни для сканирования, ни для ревизии (рис. 8). 
При выполнении ИОУЗИ после декомпрессии невральных структур основными целями являются выявление и локализация субстрата компрессии, подтверждение и документация факта декомпрессии. В случае выявления субстрата компрессии по ИОУЗИ его удаляли и после проводили контрольное ИОУЗИ. Документация факта адекватной декомпрессии в виде фото- и видеоматериалов данных ИОУЗИ позволяет контролировать эффективность действий хирурга, имеет юридическое значение и, кроме того, может представлять интерес в научном плане. В нашем исследовании мы установили по ИОУЗИ «остаточную» часть секвестра, не выявленную хирургом на этапе ревизии после проведенной декомпрессии, в 2 (4%) случаях.
Оперативная и высокоинформативная интраоперационная визуализация структур, недоступных для прямого осмотра во время хирургической операции, с помощью ИОУЗИ дополняет представление об интраоперационной анатомии и топографии. Это преимущество позволяет эффективнее реализовывать различные хирургические задачи на каждом этапе операции, которыми и определяется наш оригинальный алгоритм применения ИОУЗИ (рис. 9). 
ИОУЗИ по сравнению с другими методами интраоперационной визуализации (интраоперационные КТ и МРТ) имеет определенные достоинства и недостатки. К достоинствам метода можно отнести доступность, безвредность, простоту использования, высокую разрешающую способность, возможность визуализации в реальном времени; к недостаткам — низкое качество визуализации на этапе до флавотомии и при грубой компрессии невральных структур, невозможность визуализации костных тканей, а также структур, находящихся за пределами акустического окна.
С целью исследования качества хирургического лечения оценены инвазивность, динамика интенсивности корешкового болевого синдрома по ВАШ корешковой боли, динамика качества жизни по шкале Карновского и шкале Oswestry Disability Index, осложнения хирургического лечения.
Для оценки инвазивности хирургического вмешательства исследованы эффективная доза облучения рентгеновского аппарата, длина разреза, длительность операции, объем кровопотери, время активизации, длительность стационарного периода лечения. Эффективная доза облучения составила 0,01—0,2 мЗв (в среднем 0,02 мЗв) и была статистически незначимой. Все пациенты активизировались на следующие сутки после операции. Длина разреза варьировала от 3 до 6 см и зависела от толщины подкожной жировой клетчатки. Применение ИОУЗИ, равно как и межостистой фиксации, не влияло на длину разреза. В среднем длительность операций составила 128 мин, кровопотеря — 38 мл, длительность стационарного периода лечения — 8 дней. Таким образом, полученные результаты свидетельствуют о соответствии проведенного хирургического лечения принципам мини-инвазивности.
До операции показатель интенсивности корешковой боли по ВАШ в среднем был равен 5,7 балла, через 1 нед, 3 мес и 1 год после операции — соответственно 0,7, 0,6 и 0,5 балла. По шкале Карновского качество жизни до операции, через 1 нед, 3 мес и 1 год после операции оценено 68, 88, 92, 90 баллами соответственно, по шкале Oswestry — 41, 12, 10, 11 баллами. Двигательные и чувствительные нарушения после операции уменьшились у всех пациентов. У 2 (4%) пациентов наблюдалось преходящее нарастание пареза стопы в раннем послеоперационном периоде.
Не отмечено осложнений хирургического лечения связанных с ошибкой уровня операции, межостистым имплантом, кровопотерей, нагноением послеоперационной раны, гематомой или инородными телами в ране. Также не возникло случаев послеоперационной ликвореи, хотя непреднамеренное вскрытие твердой мозговой оболочки отмечено у 1 пациента. В течение 1 года послеоперационного наблюдения за пациентами выполнено 4 (8%) реоперации, из них 3 (6%) были по поводу рецидива грыжи диска, 1 (2%) в связи с истечением подкожной «серомы» и угрозой инфицирования раны. Летальных случаев не было.
Следовательно, ИОУЗИ в спинальной хирургии является простым в освоении и использовании, безвредным, недорогим и широкодоступным методом интраоперационной визуализации в реальном времени, данные которого могут быть сопоставимы с данными интраоперационных КТ и МРТ, а порой и превосходить их. Для ИОУЗИ пригодны практически все современные аппараты УЗИ, наиболее эффективным и универсальным датчиком, по нашему мнению, является датчик Craniotomy 8862 с частотой 10—3,8 MГц и апертурой 29×10 мм.
Длительность ИОУЗИ незначительна и в среднем составляет 6 мин. На этапе операции до флавотомии ИОУЗИ позволяет подтвердить правильность выбора уровня операции, выбрать оптимальное место для безопасного начала флавотомии, оптимизировать объем и форму флавотомии, аркотомии и медиальной фасетотомии, выявить предоперационное смещение секвестра, что значительно облегчает выполнение следующих этапов операции.
На этапе после флавотомии до декомпрессии невральных структур ИОУЗИ позволяет идентифицировать все анатомические структуры и ткани в зоне операции, выявить и локализовать субстрат компрессии невральных структур и оптимизировать доступ к нему, контролировать радикальность декомпрессии. После проведения декомпрессии невральных структур ИОУЗИ позволяет контролировать радикальность декомпрессии, подтвердить и документировать факт декомпрессии в виде фото и видеоматериалов.
Таким образом, применение ИОУЗИ в хирургии дегенеративных заболеваний поясничного отдела позвоночника позволяет улучшить результаты хирургического лечения.
Сбор и обработка материала, написание текста — М.А.
Концепция и дизайн исследования, редактирование — С.В.
Статистическая обработка — Р.Л.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.