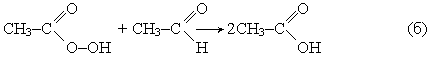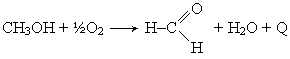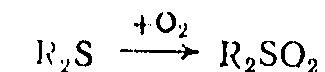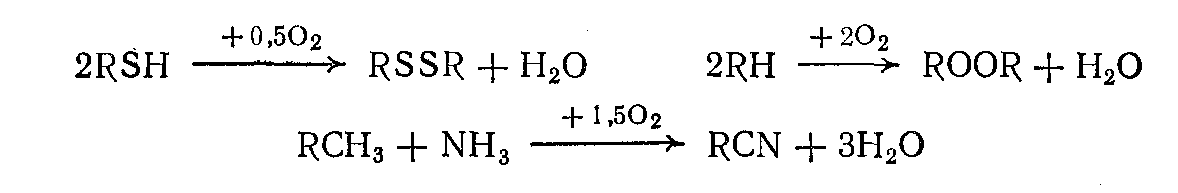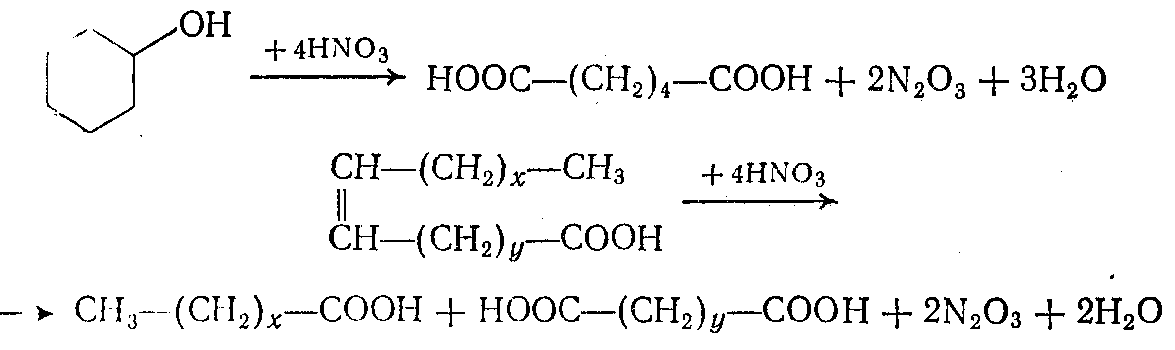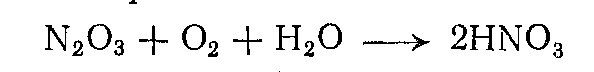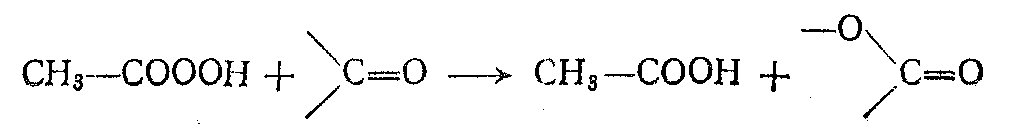Неверно что под неполным окислением углеводородов подразумевают
Неверно что под неполным окислением углеводородов подразумевают
5. Процессы окисления
Неполное окисление углеводородов получило значительное распространение в современном промышленном органическом синтезе. При этом получают спирты, фенолы, альдегиды, кетоны, органические кислоты, ангидриды и эпоксисоединения.
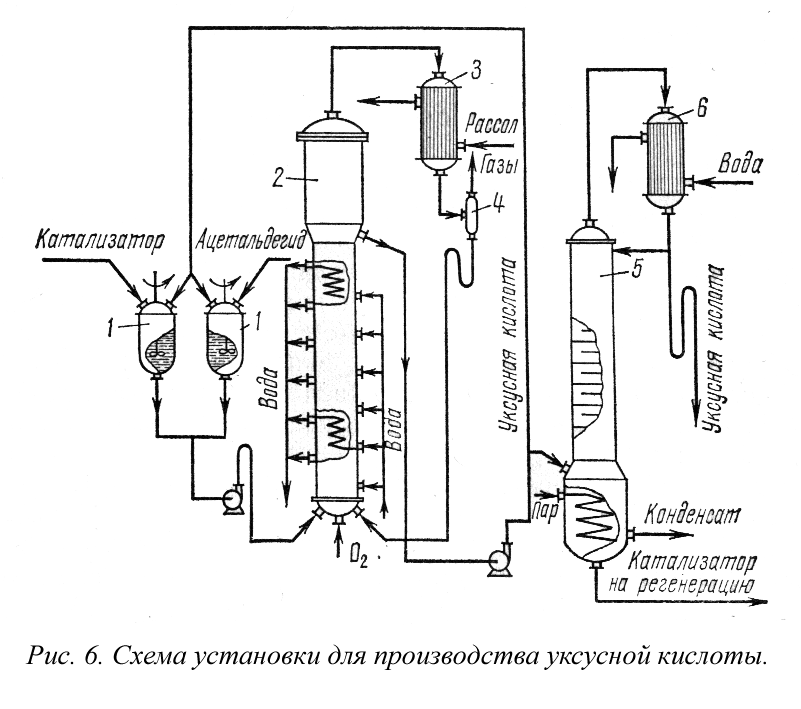
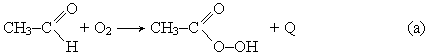
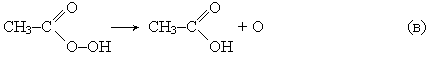
Производство уксусной кислоты. Получение уксусной кислоты окислением ацетальдегида протекает в две стадии. Сначала при окислении ацетальдегида образуется нестойкая надуксусная кислота:
которая далее вновь взаимодействует с а цетальдегидом с образованием уксусной кислоты:
Возможна побочная реакция разложения надуксусной кислоты, сопровождающаяся выделением атомарного кислорода и значительного количества тепла:
Помимо этого способа уксусную кислоту получают при сухой перегонке древесины и в процессе биохимического окисления этилового спирта под влиянием бактерий (уксусного грибка).
Уксусная кислота и ее производные широко применяются в различных отраслях промышленности и народного хозяйства. Значительное количество уксусной кислоты перерабатывается в уксусный ангидрид. В качестве ацетилирующего средства уксусная кислота используется для производства ацетилцеллюлозы, при получении полупродуктов в тонком органическом синтезе. Уксусная кислота применяется в пищевой, текстильной промышленностях. Соли уксусной кислоты применяются при крашении и печатании тканей, в промышленности тонкого органического синтеза и др. Сложные эфиры уксусной кислоты применяются в качестве растворителей, душистых веществ, фруктовых эссенций.
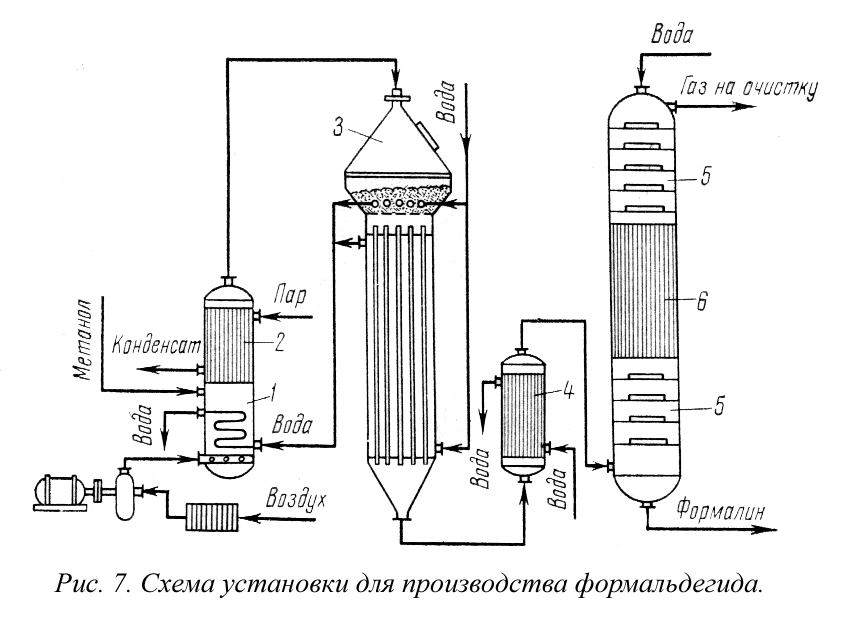
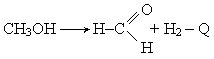
Производство формальдегида. Получение формальдегида окислением метанола широко распространено в промышленности. Этот технологический процесс изучен и разработан советским ученым Е. И. Орловым.
Пары метилового спирта окисляются кислородом воздуха при температурах 500-700° С в присутствии катализатора серебра, нанесенного на пемзу:
При подаче воздуха в количестве, несколько меньшем стехио-метрического, частично прогекает эндотермическая реакция дегидрирования метилового спирта:
На рис. 7 представлена технологическая схема производства формальдегида окислением метилового спирта. Метанол испаряется в спиртоиспарителе 1 при нагревании горячей водой до 45-55° С. Через барботер в спиртоиспаритель вводится воздух и таким образом приготовляется спиртовоздушная смесь с содержанием 0,5 г. СН 3 ОН на 1 л спиртовоздушной смеси.
Во избежание конденсации паров спирта из спиртовоздушной смеси предусмотрен спиртоперегреватель 2, в котором смесь нагревается до 110° С. Нагретая спиртовоздушная смесь поступает в контактный аппарат 3, где в слое серебряного катализатора при 650-700° С образуется формальдегид. При установившемся процессе окисление протекает автотермично. Температурный режим в слое катализатора регулируют изменением количества и температуры спир-товоздушной смеси, подаваемой в аппарат, и воды, поступающей в трубки, находящиеся в слое.
Окисление олефинов большей частью в промышленной практике проводят для получения окисей олефинов (эпоксидов).
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола).
Химические свойства алканов
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом SR.
1. Реакции замещения
В реакциях данного типа происходит разрыв связей углерод-водород
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
Механизм реакции
Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl•, •Н, •СН3,•СН2• и т.д.);
Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора:
3) Обрыв (гибель) цепи:
Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы:
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО4, К2Cr2О7).
Горение в кислороде
А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
Б) неполное сгорание при недостатке кислорода:
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (
200 о С) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
Дегидрирование
Отщепление водорода происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
При дегидрировании остальных алканов образуются алкены:
При дегидрировании н-бутана образуются бутен-1 и бутен-2 (последний в виде цис- и транс-изомеров):
Дегидроциклизация
Изомеризация
Химические свойства циклоалканов
Химические свойства циклоалканов с числом атомов углерода в циклах больше четырех, в целом практически идентичны свойствам алканов. Для циклопропана и циклобутана, как ни странно, характерны реакции присоединения. Это обусловлено большим напряжением внутри цикла, которое приводит к тому, что данные циклы стремятся разорваться. Так циклопропан и циклобутан легко присоединяют бром, водород или хлороводород:
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Химические свойства алкадиенов
Реакции присоединения
Например, присоединение галогенов:
Бромная вода обесцвечивается.
В обычных условиях присоединение атомов галогена происходит по концам молекулы бутадиена-1,3, при этом π-связи разрываются, к крайним атомам углерода присоединяются атомы брома, а свободные валентности образуют новую π-связь. Таким образом, как бы происходит «перемещение» двойной связи. При избытке брома может быть присоединена еще одна его молекула по месту образовавшейся двойной связи.
Реакции полимеризации
Химические свойства алкинов
Алкины являются ненасыщенными (непредельными) углеводородами в связи с чем способны вступать в реакции присоединения. Среди реакци присоединения для алкинов наиболее распространено электрофильное присоединение.
Галогенирование
Поскольку тройная связь молекул алкинов состоит из одной более прочной сигма-связи и двух менее прочных пи-связей они способны присоединять как одну, так и две молекулы галогена. Присоединение одной молекулой алкина двух молекул галогена протекает по электрофильному механизму последовательно в две стадии:
Гидрогалогенирование
Присоединение молекул галогеноводорода, также протекает по электрофильному механизму и в две стадии. В обоих стадиях присоединение идет в соответствии с правилом Марковникова:
Гидратация
Присоединение воды к алкинами происходит в присутсвии солей рути в кислой среде и называется реакцией Кучерова.
В результате гидратации присоединения воды к ацетилену ообразуется ацетальдегид (укусный альдегид):
Для гомологов ацетилена присоединение воды приводит к образованию кетонов:
Гидрирование алкинов
Алкины реагируют с водородом в две ступени. В качестве катализаторов используют такие металлы как платина, палладий, никель:
Тримеризация алкинов
При пропускании ацетилена над активированным углем при высокой температуре из него образуется смесь различных продуктов, основным из которых является бензол – продукт тримеризации ацетилена:
Димеризация алкинов
Также ацетилен вступать в реакцию димеризации. Процесс протекает в присутствии солей меди как катализаторов:
Окисление алкинов
Алкины сгорают в кислороде:
Взаимодействие алкинов с основаниями
Алкины с тройной C≡C на конце молекулы, в отличие от остальных алкинов, способны вступать в реакции, в которых атом водорода при тройной связи замещается металл. Например, ацетилен реагирует с амидом натрия в жидком аммиаке:
а также с аммиачным раствором оксида серебра, образуя нерастворимые солеподобные вещества называемые ацетиленидами:
Благодаря такой реакции можно распознать алкины с концевой тройной связью, а также выделить такой алкин из смеси с другими алкинами.
Следует отметить, что все ацетилениды серебра и меди являются взрывоопасными веществами.
Ацетилениды способны реагировать с галогенпроизводными, что используется при синтезе более сложных органических соединений с тройной связью:
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.
Неверно что под неполным окислением углеводородов подразумевают
5. Процессы окисления
Неполное окисление углеводородов получило значительное распространение в современном промышленном органическом синтезе. При этом получают спирты, фенолы, альдегиды, кетоны, органические кислоты, ангидриды и эпоксисоединения.
Производство уксусной кислоты. Получение уксусной кислоты окислением ацетальдегида протекает в две стадии. Сначала при окислении ацетальдегида образуется нестойкая надуксусная кислота:
которая далее вновь взаимодействует с а цетальдегидом с образованием уксусной кислоты:
Возможна побочная реакция разложения надуксусной кислоты, сопровождающаяся выделением атомарного кислорода и значительного количества тепла:
Помимо этого способа уксусную кислоту получают при сухой перегонке древесины и в процессе биохимического окисления этилового спирта под влиянием бактерий (уксусного грибка).
Уксусная кислота и ее производные широко применяются в различных отраслях промышленности и народного хозяйства. Значительное количество уксусной кислоты перерабатывается в уксусный ангидрид. В качестве ацетилирующего средства уксусная кислота используется для производства ацетилцеллюлозы, при получении полупродуктов в тонком органическом синтезе. Уксусная кислота применяется в пищевой, текстильной промышленностях. Соли уксусной кислоты применяются при крашении и печатании тканей, в промышленности тонкого органического синтеза и др. Сложные эфиры уксусной кислоты применяются в качестве растворителей, душистых веществ, фруктовых эссенций.
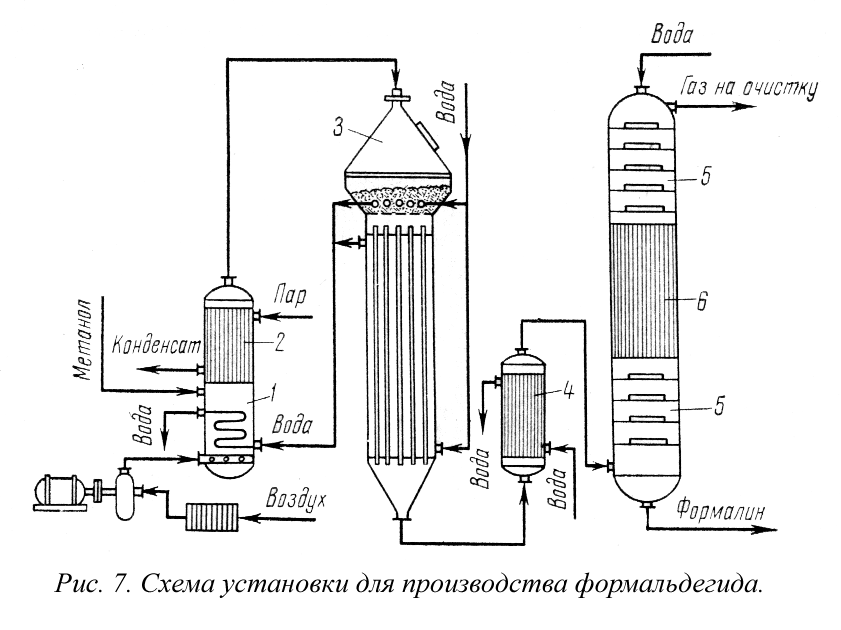
Производство формальдегида. Получение формальдегида окислением метанола широко распространено в промышленности. Этот технологический процесс изучен и разработан советским ученым Е. И. Орловым.
Пары метилового спирта окисляются кислородом воздуха при температурах 500-700° С в присутствии катализатора серебра, нанесенного на пемзу:
При подаче воздуха в количестве, несколько меньшем стехио-метрического, частично прогекает эндотермическая реакция дегидрирования метилового спирта:
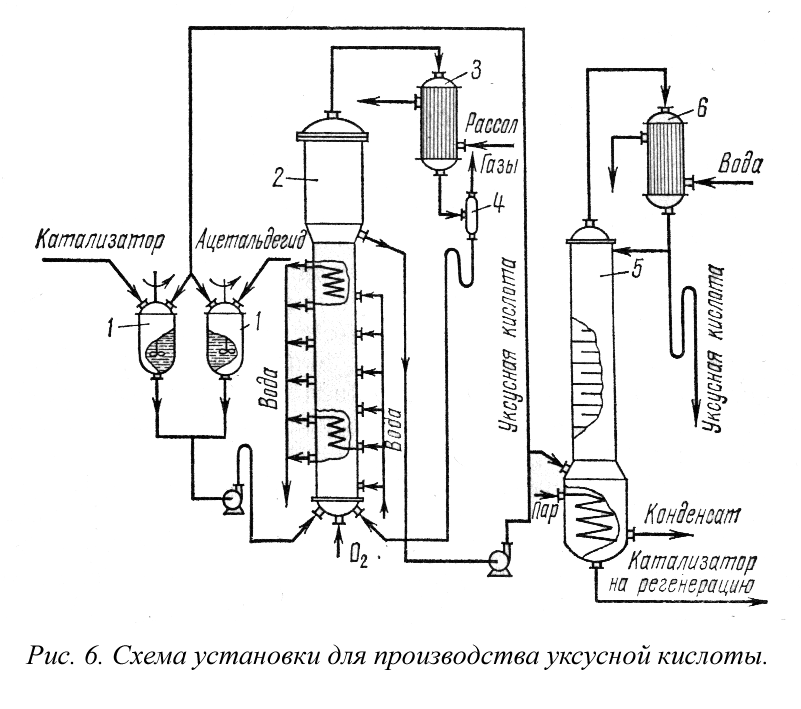
На рис. 7 представлена технологическая схема производства формальдегида окислением метилового спирта. Метанол испаряется в спиртоиспарителе 1 при нагревании горячей водой до 45-55° С. Через барботер в спиртоиспаритель вводится воздух и таким образом приготовляется спиртовоздушная смесь с содержанием 0,5 г. СН 3 ОН на 1 л спиртовоздушной смеси.
Во избежание конденсации паров спирта из спиртовоздушной смеси предусмотрен спиртоперегреватель 2, в котором смесь нагревается до 110° С. Нагретая спиртовоздушная смесь поступает в контактный аппарат 3, где в слое серебряного катализатора при 650-700° С образуется формальдегид. При установившемся процессе окисление протекает автотермично. Температурный режим в слое катализатора регулируют изменением количества и температуры спир-товоздушной смеси, подаваемой в аппарат, и воды, поступающей в трубки, находящиеся в слое.
Окисление олефинов большей частью в промышленной практике проводят для получения окисей олефинов (эпоксидов).
Теоретическая часть. Окисление — наиболее распространенный метод получения различных кислородсодержащих соединений из углеводородного сырья и некоторых функциональных производных



Окисление — наиболее распространенный метод получения различных кислородсодержащих соединений из углеводородного сырья и некоторых функциональных производных углеводородов различных классов. Практическое значение процессов окисления в промышленности основного органического и нефтехимического синтеза трудно переоценить. Их первостепенную роль обусловили следующие причины:
1. Многообразие реакций окисления, что позволяет использовать их для первичной переработки углеводородного сырья и производить на их основе различные ценные соединения (спирты, моно- и дикарбоновые кислоты и их ангидриды, а-оксиды, нитрилы и др.), являющиеся растворителями, промежуточными продуктами органического синтеза, мономерами и исходными веществами в производстве полимерных материалов, поверхностно-активных веществ, пластификаторов и т. д.
2.Доступностью и низкой стоимостью большинства окислителей, среди которых главное место занимает кислород воздуха. Это определяет более высокую экономичность синтеза ряда продуктов методами окисления по сравнению с другими способами их производства. В ряде процессов в качестве агентов окисления можно использовать гипохлориты, хлораты, перманганаты, азотную кислоту и оксид азота(IУ), сульфат ртути, оксиды и пероксиды некоторых металлов, пероксид водорода.
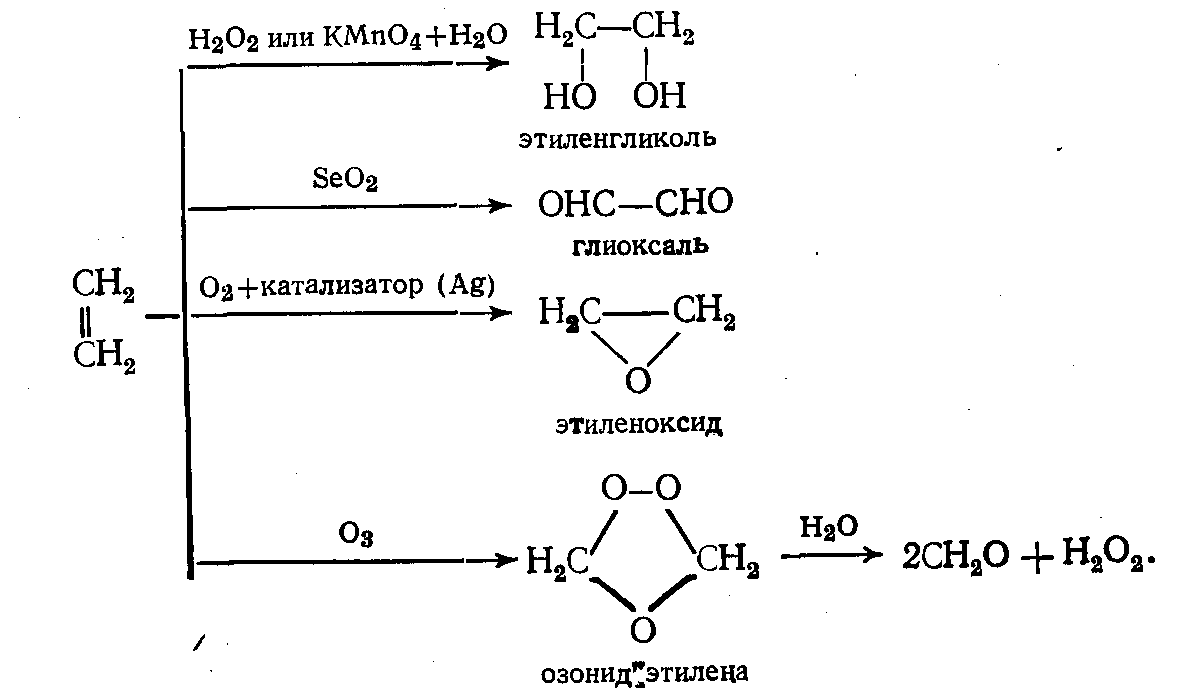
В некоторых случаях одно и то же сырье можно окислять различными агентами, но чаще агенты окисления обладают избирательным действием. На примере этилена можно показать, окислении различными какие продукты образуются при его агентами:
С этой точки зрения окисление следует считать одним из самых перспективных процессов органического синтеза, играющим все более важную роль в научных исследованиях и промышленности.
Дать точное определение реакций окисления в органической химии не так просто. Они большей частью не сопровождаются изменением валентности каких-либо атомов, как в неорганической химии. Это наблюдается только при окислении по атомам азота, серы, фосфора и других элементов, способных существовать в нескольких валентных состояниях:
Нельзя выбрать критерием и другой признак и определить окисление, как реакцию введения атомов кислорода в органическую молекулу. Это легко опровергается такими примерами, как гидратация олефинов или гидролиз хлорпроизводных, где кислородосодержащие соединения образуются без окислителей. Дополнительная трудность возникает из-за того, что окисление иногда протекает без увеличения числа атомов кислорода в исходной молекуле или даже с образованием соединений, совсем не содержащих кислорода. В этих случаях окисление сводится к удалению атомов водорода путем их связывания кислородом в виде воды, причем такой же результат обычно достигается и вследствие дегидрирования.
Таким образом, остается считать собственно окислением превращение органических веществ под влиянием тех или иных окисляющих агентов.
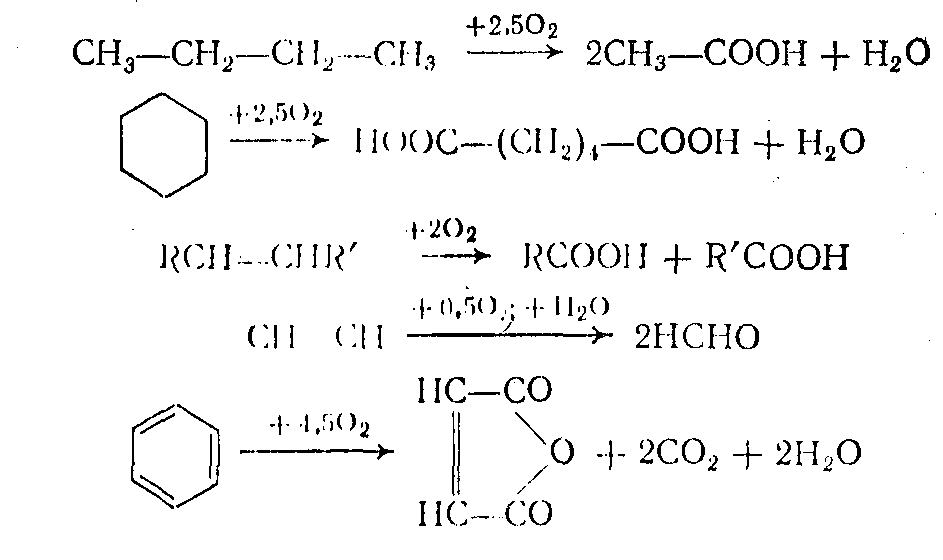
В окислительных превращениях следует различать полное и неполное окисление. Под полным окислением понимают процесс сгорания органических веществ с образованием воды, диоксида углерода, оксидов азота и серы:
Основное назначение этого процесса — получение тепловой энергии для промышленности, транспорта и в быту. Но в промышленности органического синтеза этот процесс является нежелательным, так как ведет к снижению выхода целевого продукта и большому количеству выделяемого тепла.
Имеющие промышленное значение реакции неполного (частичного) окисления можно разделить на три основные группы.
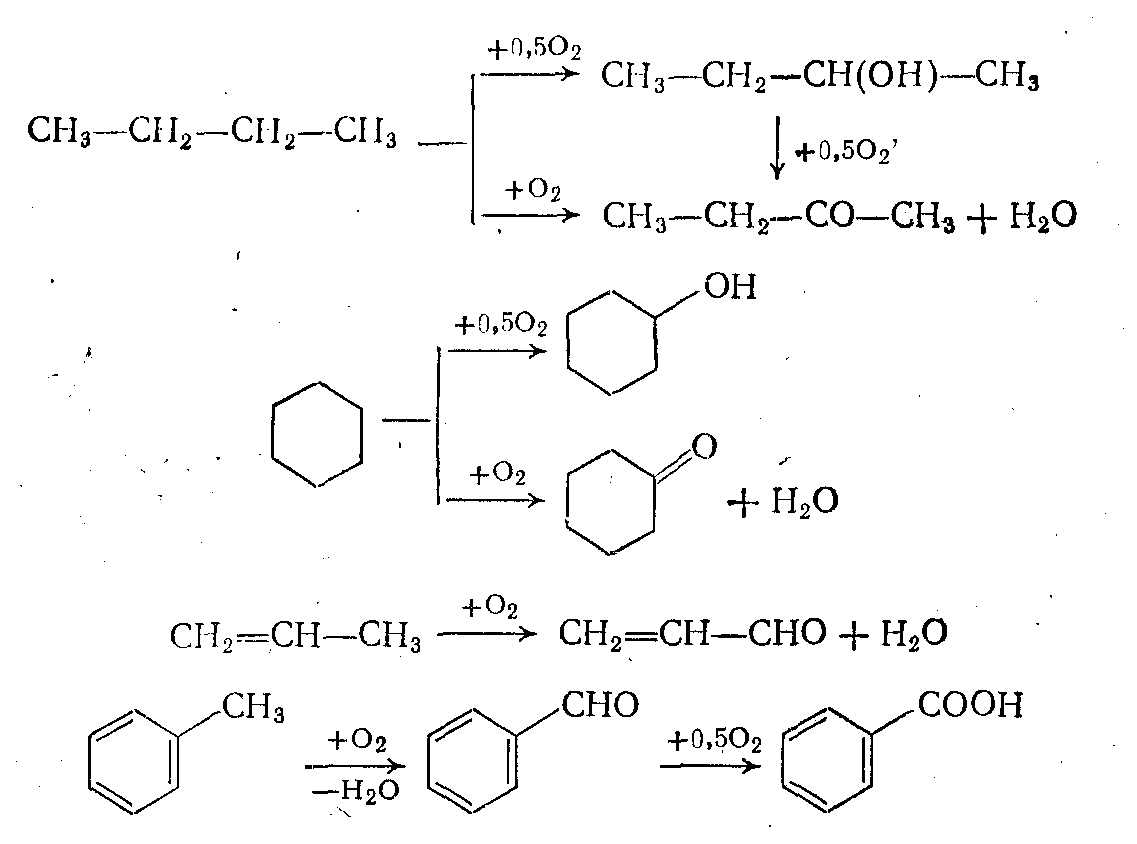
1. Окисление без разрыва связи С—С. В этом случае окисление может протекать: по насыщенному атому углерода парафинов, циклопарафинов, олефинов; по боковым цепям алкилароматических соединений; по частично окисленным атомам углерода в спиртах и альдегидах;
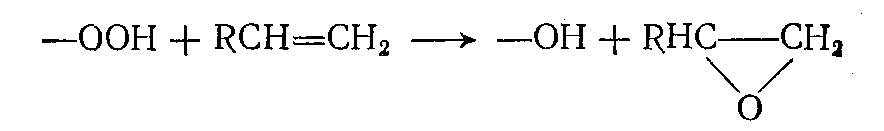
по двойной связи олефинов с образованием карбонильных соединений или а-оксидов (эпоксидирование); по атомам серы, фосфора и других элементов.
2. Деструктивное окисление. В этом случае окисление может протекать по связям: С-С, С=С, С≡С, Саром-Саром.
3. Окислительная конденсация, окислительный аммонолиз — окисление, сопровождающееся связыванием молекул исходных реагентов.
Кроме перечисленных промышленное значение имеют также процессы окислительного дегидрирования, занимающие промежуточное положение между окислением и дегидрированием.
В лабораторной технике и тонком органическом синтезе нередко применяют такие окислительные агенты, как перманганаты (в щелочной, нейтральной или кислой среде), бихроматы, хромовый ангидрид, перекиси некоторых металлов (марганца, свинца, натрия) и т. д., то в промышленности основного органического и нефтехимического синтеза стараются пользоваться более дешевыми окислителями и только в отдельных случаях применяют агенты, способные к реакциям, невыполнимым при помощи других окислителей:
1.Молекулярный кислород (в виде воздуха, технического кислорода или даже азото-кислородных смесей с небольшим содержанием О2) является важнейшим из окислительных агентов. Его применяю для проведения большинства рассмотренных выше реакций окисления. Концентрированный кислород оказывает более сильное окисляющее действие, но его применение связано с дополнительными затратами на разделение воздуха. При окислении в газовой фазе, когда примесь азота затрудняет выделение продуктов или их рециркуляцию, используют и технический кислород. Меньшую скорость реакции при окислении воздухом компенсируют повышением температуры или увеличением общего давления, ведущим к росту парциального давления кислорода.
Азотная кислота как окислитель никогда не применяется для реакций с парафинами. Для нее наиболее типичны реакции деструктивного окисления циклических соединений и веществ с ненасыщенными связями, идущие с участием НNO3 с лучшим выходом, чем при окислении кислородом:
При окислении азотной кислотой последняя раскисляется до окислов азота ( 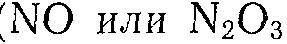
3.Перекисные соединения, главным образом перекись водорода
надуксусная кислота (а в последнее время и гидроперекиси). Ввиду относительной дороговизны их используют только для таких реакций, которые под влиянием молекулярного кислорода или азотной кислоты не протекают. Это прежде всего относится к процессам эпоксидирования ненасыщенных соединений:
Меньшее значение имеет реакция надкислот с кетонами, ведущая к сложным эфирам или лактонам (реакция Байера — Виллигера):
Перекись водорода обычно применяется в виде 30%-ного водного раствора. Она дает с карбоновыми кислотами соответствующие надкислоты по реакции, аналогичной этерификации:
Важной характеристикой окисления является период индукции: он может длиться от нескольких секунд до нескольких часов. Продолжительность его уменьшают повышением температуры или добавлением промоторов (пероксидов, альдегидов и др.).
Способность к окислению атомов углерода зависит от энергии разрыва связи С—Н и возрастает в ряду 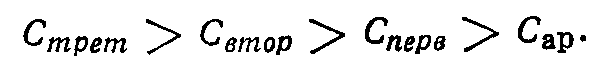
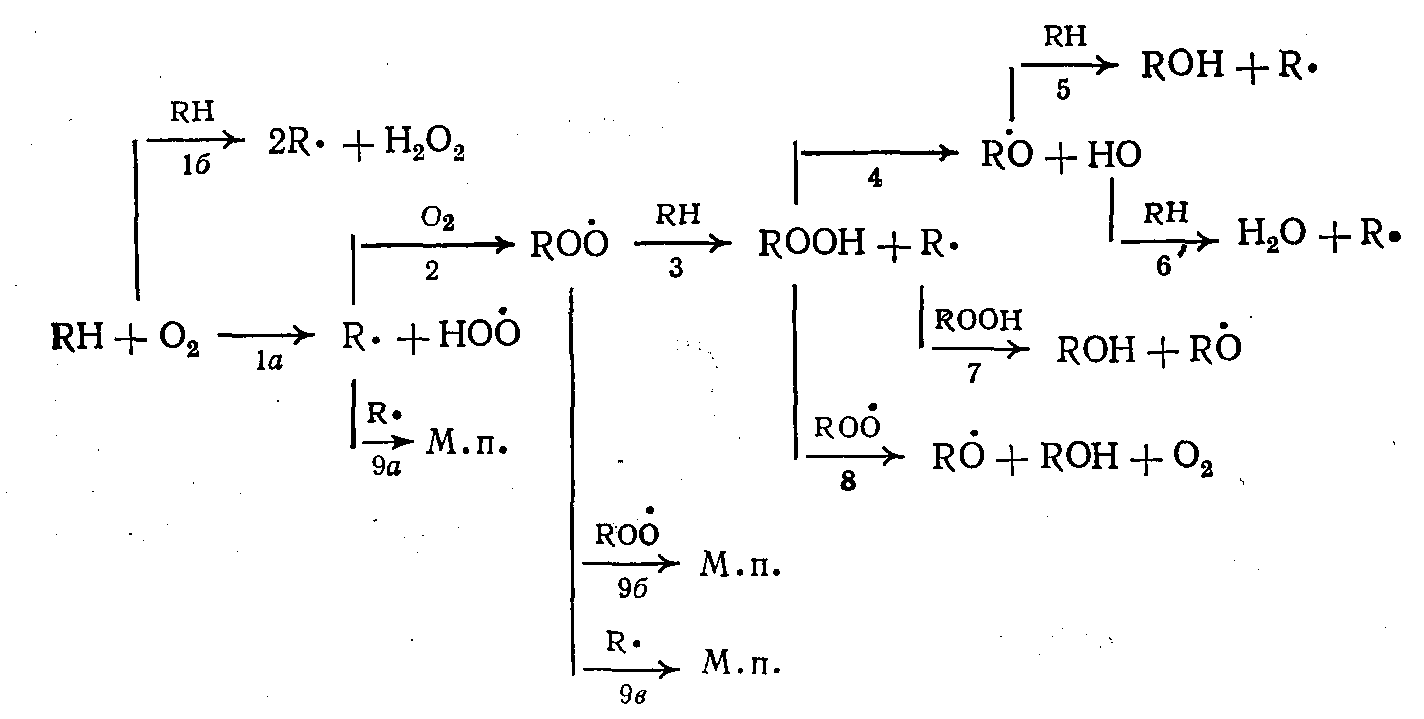
Первичным молекулярным продуктом при окислении углеводорода является вторичный гидропероксид. Окисление протекает по цепному свободно-радикальному механизму с вырожденным разветвлением. В несколько упрощенном виде это можно представить следующим образом:
где 1а, 16— зарождение цепи; 2, 3— продолжение цепи; 4— 8 — вырожденное разветвление; 9а—9в — обрыв цепи; М. п. — молекулярные продукты.
При жидкофазном окислении из-за высокой концентрации углеводородов образование свободных радикалов более вероятно по тримолекулярной реакции 16, чем по бимолекулярной 1а.
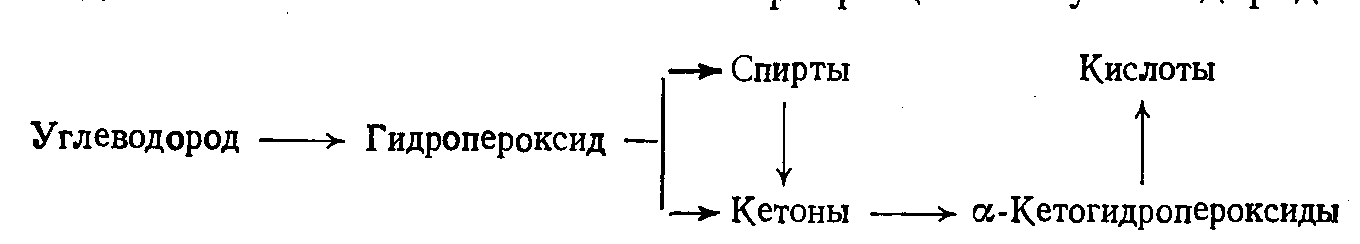
Образующийся в процессе гидропероксид далее превращается в молекулярные продукты — спирты, кетоны, сложные эфиры и т. д. Продукты окисления в большинстве своем более реакционноспособны, чем исходный углеводород, и подвергаются дальнейшему окислению со сравнительно большей скоростью.
Радикально-цепное окисление предполагает осуществление цепных реакций с участием углеводородных (R 

R 



Гидропероксиды, даже наиболее устойчивые из них, не образуются со 100 %-ой селективностью и содержат примеси соответствующих спиртов, альдегидов и кетонов.
На первой стадии окисления, называемой стадией зарождения цепи, происходит образование свободных радикалов под влиянием внешних факторов (температуры, катализатора, излучения и т.д.):
RH + O2 R 

2RH + O2 2R 
Установлено, что при жидкофазном окислении углеводородов, у которых прочность связи С – Н более 375 кДж/моль, зарождение цепи происходит по бимолекулярной реакции (1), а для углеводородов с менее прочными связями – по тримолекулярной реакции (2).
Образовавшиеся свободные радикалы вступают в реакцию со стабильными молекулами; при этом происходит развитие (продолжение) цепи.
Продолжение цепи может быть представлено как последовательность двух элементарных актов, в которой во втором акте образуется радикал, начавший цепь и молекула продукта окисления:
R 

ROO 

Так как при газофазном окислении температура (350–500 о С) выше, чем при жидкофазном окислении (100–200 о С), то в условиях первого конкурируют два направления продолжения цепи: а) образование пероксидного радикала и б) образование олефина с тем же числом атомов углерода.
ROO 
R 
олефин +HOO 
Далее превращение пероксидного радикала ROO 
ROO 

R / СНО + R // О 
ROO 
R / СОR // + НО 

При газофазном окислении преобладают реакции распада, где значительную роль играет радикал НОО 

Продолжение цепи происходит также в результате взаимодействия пероксидного радикала с молекулами альдегидов, кетонов, спиртов, образовавшихся в предыдущих стадиях:
ROO 

Распад гидропероксида и взаимодействие его с другими продуктами обусловливает вырожденное разветвление цепи: RООН RO 

RООН + R / СОR // RO 

В условиях жидкофазного окисления распад гидропероксида также идет и по реакциям второго порядка: через стадию ассоциации гидропероксида в димер, который распадается с большей скоростью, чем гидропероксид: 2RООН RОО … НООR RО 

Поэтому вещества, способные к образованию водородных связей, (спирты, кислоты и др.), ускоряют вырожденное разветвление цепи:
RОО … НОR / RО 

RОО … НОСR RО 

При взаимодействии двух свободных радикалов происходит обрыв цепи с образованием молекулярных продуктов: 2R 
2R 
Так как в реакционной смеси преобладают наименее реакционноспособные пероксидные радикалы, то обрыв цепи чаще происходит на них.
Обрыв цепи вызывают также ингибиторы, которыми могут служить фенолы, амины, меркаптаны и т.д. При взаимодействии с пероксидными и другими радикалами ингибиторы образуют стабильные продукты:
RОО 
В условиях газофазного окисления обрыв цепи большей частью происходит в результате захвата радикала поверхностью стенок аппарата:
RОО
НОО 
НО
Состав конечных продуктов в основном определяется условиями проведения процесса, природой исходного углеводородного сырья и образовавшихся пероксидов.
Первичные и вторичные гидропероксиды под влиянием свободных радикалов образуют неустойчивые радикал-гидропероксиды, распад которых приводит к образованию альдегидов и кетонов:
НО
RСН2ООН RСНООН RСНО + НО 
НО
R2СНООН R2СООН R2СО + НО 
Третичные пероксиды при цепной реакции дают не только спирт с тем же числом углеродных атомов, но и кетон и спирт, являющиеся продукта-ми деструкции по связи С – С.
R / 

R3СООН R3СО 
– R / ОН R3СОН + R / 
Образовавшиеся продукты окисления (спирты, альдегиды, кетоны) при дальнейшем действии О2 могут претерпевать более глубокие превращения. В условиях газофазного окисления образующиеся продукты больше подвергаются окислительному действию, чем в жидкофазном. Поэтому в газофазных процессах продукты окисления содержат практически все возможные кислородсодержащие продукты, включая оксиды углерода.
На практике для сокращения периода индукции, увеличения скорости и селективности процесса применяют гомогеннокаталитические добавки. В газофазном окислении такими добавками являются оксиды азота, хлор, бромид водорода; в жидкофазном – растворимые в воде соли металлов переменной валентности (кобальта, меди, марганца, железа и др.).Экспериментальные данные позволяют принять такую последовательность окислительных превращений углеводорода:
На начальном этапе окисления углеводорода скорость образования промежуточных кислородсодержащих соединений больше скорости их последующего превращения, в результате чего концентрация этих соединений возрастает во времени.
С другой стороны, по мере роста их концентрации скорость превращения кислородсодержащих соединений увеличивается. Это приводит к состоянию, при котором скорости образования и превращения промежуточных соединений становятся практически равными, а суммарная концентрация их — максимальной для данных условий. Максимально возможная концентрация этих соединений зависит от их реакционной способности: чем меньше реакционная способность промежуточного соединения, тем выше его кинетически равновесная концентрация и, следовательно, тем больше его доля в продуктах окисления.
Окисление спиртов по гидроксильной группе протекает в 15—20 раз быстрее, чем по метиленовым группам, и в случае вторичных спиртов приводит к образованию главным образом кетонов. При дальнейшем окислении кетонов получаются продукты более глубокого окисления — кислоты, сложные эфиры, оксикислоты, лактоны и др. При образовании кислот происходит разрыв углеродной цепочки исходной молекулы. Поэтому карбоксилсодержащие продукты окисления могут значительно отличаться от исходного углеводорода по молекулярной массе.