Неструктурные белки вируса ящура что это
Что такое ящур, меры его профилактики
Передачи инфекции от человека к человеку не происходит. Но наиболее восприимчивы к ящуру дети, взрослые заболевают редко.
Возбудителем ящура является РНК-содержащий вирус из семейства пикорнавирусов, характеризуется высокой степенью контагиозности (болезнетворности) и дерматотропностью (сродством по отношению к коже). По антигенной структуре подразделяется на 7 серотипов, в каждом из которых различают несколько антигенных вариантов. На территории СНГ обычно встречаются вирусы типов О и А.
У людей болезнь начинается с сильного озноба, подъема температуры до 39-40°, головной боли, потери аппетита, мышечных болей, особенно в области поясницы. Уже в первые сутки больной ощущает сухость и жжение во рту, сильное слюнотечение. Затем появляются пузырьковые высыпания от 1 до 3 мм диаметром. Особенно их много на кончике и по краям языка, а также на слизистой оболочке щек, на деснах и губах. Содержимое пузырьков прозрачно, желтоватого цвета, затем мутнеет, пузырьки увеличиваются, образуя эрозии.
Дети жалуются на затруднение при глотании, на боли при жевании, разговоре; становятся раздражительными, полностью отказываются от еды. Нередко выделение слюны столь обильно, что она вытекает струей. Высыпания имеются на слизистой оболочке носа, желудка, конъюнктиве, а также на коже лица, предплечий, кистей, голеней и стоп (особенно между пальцами рук и ног).
Эпизоотическая ситуация по ящуру на территории Камчатского края благополучная, но из-за обнаружения очагов в некоторых субъектах ДФО, в крае усиливаются профилактические мероприятия в целях недопущения завоза инфекции.
Следует помнить, что во избежание инфекционных и паразитарных болезней, общих для человека и животных, нельзя приобретать мясо, молоко и другую продукцию животного происхождения в местах несанкционированной торговли без ветеринарной справки на продукцию.
Разработка и применение иммуноферментной тест-системы для обнаружения антител к неструктурным белкам вируса ящура в сыворотках крови крупного рогатого скота тема диссертации и автореферата по ВАК РФ 03.00.06, кандидат биологических наук Яковлева, Анастасия Сергеевна
Оглавление диссертации кандидат биологических наук Яковлева, Анастасия Сергеевна
2. ОБЗОР ЛИТЕРАТУРЫ.
2.1. Структурная организация капсида ВЯ.
2.2. Структурно-функциональная организация генома ВЯ.
2.5. Серодиагностика ящура.
2.5.1. Выявление и типирование вируса.
2.5.2. Дифференциация постинфекционных и поствакцинальных антител.
Рекомендованный список диссертаций по специальности «Вирусология», 03.00.06 шифр ВАК
Разработка и совершенствование методов иммуноферментной диагностики классической чумы свиней 2002 год, кандидат биологических наук Бьядовская, Ольга Петровна
Разработка и осуществление мер по контролю за функционированием противоящурной буферной зоны стран СНГ 2001 год, кандидат ветеринарных наук Караулов, Антон Константинович
Разработка методов иммуноферментного анализа для выявления антител к вирусу репродуктивно-респираторного синдрома свиней 2004 год, кандидат ветеринарных наук Каньшина, Анжелика Владимировна
Промышленные технологии изготовления компонентов моно- и комплексных диагностикумов инфекционных заболеваний животных 2008 год, доктор биологических наук Матвеева, Ирина Николаевна
Разработка технологии иммуноферментной тест-системы для выявления антител к аденовирусам крупного рогатого скота 2001 год, кандидат биологических наук Третьякова, Ирина Владимировна
Введение диссертации (часть автореферата) на тему «Разработка и применение иммуноферментной тест-системы для обнаружения антител к неструктурным белкам вируса ящура в сыворотках крови крупного рогатого скота»
Обнаружение антител к неструктурным белкам вируса ящура является важным инструментом контроля за заболеванием. Этот метод позволяет дифференцировать вакцинированных животных от реконвалесцентов и выявлять бессимптомных вирусоносителей среди вакцинированного поголовья. В связи с тем, что Россия проводит политику противоящурной вакцинации скота вдоль своих южных границ, наличие диагностических средств, позволяющих обнаруживать в вакцинированных стадах инфицированных животных, чрезвычайно актуально.
В настоящее время на мировом рынке ветеринарных диагностикумов представлено несколько иностранных коммерческих тест-систем для выявления антител к неструктурным белкам вируса ящура. Они основаны на использовании в качестве антигенов синтетических пептидов или рекомбинантных белков вируса ящура, экспрессированных в E.coli или в бакуловирусной системе. Однако отечественных тест-систем до сих пор создано не было.
Цели и задачи исследования. Основная цель нашей работы заключалась в получении рекомбинантных антигенов и разработке на их основе иммуноферментной тест-системы, позволяющей выявлять антитела к неструктурным белкам вируса ящура.
Для достижения поставленной цели необходимо было решить следующие задачи:
— провести молекулярное клонирование и экспрессию в E.coli генов неструктурных белков ЗА, ЗВ и ЗАВ вируса ящура;
— отработать условия экспрессии и очистки, обеспечивающие высокий выход рекомбинантных белков;
— исследовать антигенную активность и специфичность полученных белков;
— разработать на основе рекомбинантных белков ЗА, ЗВ и ЗАВ иммуноферментные тест-системы для определения антител к неструктурным белкам вируса ящура и сравнить их по чувствительности и специфичности между собой и с коммерческими наборами;
— на основе наиболее чувствительной и специфичной тест-системы разработать диагностические наборы для выявления антител к неструктурным белкам вируса ящура в сыворотках крови крупного рогатого скота;
— оценить с помощью разработанных наборов отечественные противоящурные вакцины на способность индуцировать антитела к неструктурным белкам вируса ящура у животных;
— применить разработанные наборы в диагностических исследованиях. Научная новизна исследования. Впервые в России получены рекомбинантные неструктурные белки ЗА, ЗВ и ЗАВ вируса ящура и на их основе разработаны иммуноферментные тест-системы для дифференциации вакцинированного и инфицированного КРС.
Показано, что ИФА на основе белка ЗА превосходит по диагностической чувствительности и специфичности ИФА на основе белков ЗВ и ЗАВ.
На основе ЗА-ИФА разработаны два отечественных диагностических набора для определения антител к неструктурным белкам вируса ящура в сыворотках крови КРС иммуноферментным методом, позволяющие дифференцировать вакцинированный против ящура и инфицированный вирусом ящура КРС.
Практическая значимость исследований. В результате проведенных исследований были разработаны следующие методики:
Методика определения антител к неструктурным белкам вируса ящура в сыворотках КРС иммуноферментным методом», одобренная ученым советом и утвержденная директором Центра 30.09.04;
Методика определения антител к неструктурным белкам вируса ящура иммуноферментным методом при тестировании сывороток крови КРС в одном разведении», одобренная ученым советом и утвержденная директором Центра 21.12.04.
На основе этих методик разработаны два диагностических набора: «Набор для определения антител к неструктурным белкам вируса ящура в сыворотках крови КРС иммуноферментным методом», одобренный ученым советом и утвержденный директором Центра 30.09.04;
Набор для определения антител к неструктурным белкам вируса ящура иммуноферментным методом при тестировании сывороток крови КРС в одном разведении», одобренный ученым советом и утвержденный директором Центра 21.12.04.
Публикации научных работ. По теме диссертации опубликовано три научных работы.
Апробация работы. Материалы диссертации доложены на научной конференции «Проблемы мониторинга и генодиагностики инфекционных болезней животных» в 2004 году, на заседаниях ученого совета в 2003-2005 гг.
Основные положения, выносимые на защиту.
Рекомбинантные антигены ЗА, ЗВ и ЗАВ вируса ящура.
Иммуноферментные тест-системы на основе рекомбинантных белков ЗА, ЗВ и ЗАВ для выявления антител к неструктурным белкам вируса ящура в сыворотках крови КРС и результаты их сравнительных испытаний.
Диагностический набор для выявления антител к неструктурным белкам вируса ящура методом последовательного разведения сывороток крови КРС.
Диагностический набор для выявления антител к неструктурным белкам вируса ящура методом одного разведения сывороток крови КРС.
Результаты серомониторинга ящура с использованием разработанных диагностических наборов за 2004-2005гг.
Структура и объем работы. Диссертация изложена 110 на страницах, иллюстрирована 12 рисунками и 12 таблицами. Список используемой литературы включает 192 источника, из которых 171 иностранный.
Исследования по диссертационной работе выполнены в 2002-2005гг. в Федеральном центре охраны здоровья животных (ФГУ ВНИИЗЖ, г. Владимир).
Похожие диссертационные работы по специальности «Вирусология», 03.00.06 шифр ВАК
Создание и внедрение в промышленное птицеводство системы комплексного серологического мониторинга инфекционных болезней на основе иммуноферментного анализа 2010 год, доктор биологических наук Мудрак, Наталья Станиславовна
Разработка иммуноферментной тест-системы для выявления антител к цирковирусу свиней второго типа 2006 год, кандидат биологических наук Шкаева, Мария Александровна
Определение антигенных детерминант белков вируса гепатита С методом фагового дисплея 1999 год, кандидат биологических наук Перебоева, Лариса Александровна
Разработка и применение иммуноферментных тест-систем для определения антител к вирусу ССЯ-76 и оценки качества вируссодержащего сырья 1999 год, кандидат биологических наук Волкова, Марина Алексеевна
Разработка иммуноферментных тест-систем для определения антител к бактериям рода Salmonella серогрупп B,C и D в сыворотках крови свиней и кур 2009 год, кандидат ветеринарных наук Капускина, Юлия Викторовна
Заключение диссертации по теме «Вирусология», Яковлева, Анастасия Сергеевна
1. Проведено молекулярное клонирование и экспрессия в E.coli генов ЗА, ЗВ и ЗАВ вируса ящура. Определены условия экспрессии и очистки, обеспечивающие высокий выход рекомбинантных белков;
2. На основе полученных рекомбинантных антигенов разработан непрямой вариант ИФА для определения антител к неструктурным белкам вируса ящура в сыворотках крови КРС;
3. Проведен сравнительный анализ диагностической чувствительности и специфичности ИФА на основе белков ЗА, ЗВ и ЗАВ. Установлено, что ЗА-ИФА обладает лучшими показателями диагностической чувствительности и специфичности и позволяет наиболее достоверно дифференцировать инфицированных и вакцинированных животных;
4. На основе ЗА-ИФА разработан набор для определения антител к неструктурным белкам вируса ящура в сыворотках крови КРС методом последовательных разведений.
5. На основе рекомбинантного белка ЗА разработан иммуноферментный метод и диагностический набор для определения антител к неструктурным белкам вируса ящура по одному разведению сывороток крови КРС;
6. Результаты сравнения с зарубежными аналогами показали, что разработанные наборы превосходят по чувствительности тест-систему «Chekit FMD-ЗАВС» (Bommeli Diagnostics, Щвейцария) и сравнимы с тест-системой «Ceditest FMDV-NS ELISA» (Cedi Diagnostics, Нидерланды);
7. С использованием разработанных наборов исследовано более 1200 сывороток крови КРС, вакцинированного против ящура. Установлено, что противоящурные вакцины производства ФГУ ВНИИЗЖ и ФГУП «Щелковский биокомбинат» не вызывают у животных выработку антител к неструктурным белкам вируса ящура и соответствуют по этому показателю требованиям МЭБ.
6. ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ
Для практического использования предлагаются:
Методика определения антител к неструктурным белкам вируса ящура в сыворотках КРС иммуноферментным методом»;
Методика определения антител к неструктурным белкам вируса ящура иммуноферментным методом при тестировании сывороток крови КРС в одном разведении»;
Набор для определения антител к неструктурным белкам вируса ящура в сыворотках крови КРС иммуноферментным методом»;
Набор для определения антител к неструктурным белкам вируса ящура иммуноферментным методом при тестировании сывороток крови КРС в одном разведении».
Список литературы диссертационного исследования кандидат биологических наук Яковлева, Анастасия Сергеевна, 2005 год
1. Аминев, А.Г. Выделение и очистка экспрессированных в E.coli ЗС и 3D белков вируса ящура / А.Г. Аминев, Т.А. Сатина, Г.М. Фалина // Вирусн. болезни с.-х. животных: тез. докл. Всерос. науч.-практ. конф. — Владимир, 1995. С. 5.
2. Вакцинопрофилактика ящура в Российской Федерации / Т.З. Байбиков,
4. Гааль, Э. Электрофорез в разделении биологических молекул / Э. Гааль, Г. Медьеши, Л. Верецкеи. М.: Мир, 1982.
7. Изучение возможности использования синтетических пептидов для выявления антител к VIA-антигену вируса ящура / А.А. Луговской,
13. Маниатис, Т. Молекулярное клонирование / Т. Маниатис, Э. Фрич, Д. Д. Сэмбрук М.: Мир, 1984.
14. Медик, В.А. Статистика в медицине и биологии / В.А. Медик, М.С. Токмачев, Б.Б. Фишман- М.: Медицина, 2000.
16. Поляков, И.О. Практическое пособие по медицинской статистике / И.О. Поляков JL: Медицина, 1975.
19. Фомина, Т.А. Лабораторная диагностика ящура и других болезней, протекающих с везикулярным синдромом. Обзор литературы / Т.А. Фомина, Е.В. Гусева. Владимир, 1995.
20. Ханаан, Д. Методы трансформации. Клонирование ДНК / под ред. Д. Гловера М.: Мир, 1988.- С.140- 173.
21. Холодилов, Н.Г. Выделение плазмидной ДНК методом щелочного лизиса. Методы молекулярной генетики и генной инженерии / под ред А.В. Мазина, К.Д. Кузнеделова, А.С. Краева и др. Новосибирск: Наука, 1990.
28. Baculovirus expressed 2C of foot-and-mouth disease virus has the potential for differentiating convalescent from vaccinated animals / R.F. Meyer, G.D.
34. Belsham, G.J. Distinctive features of foot-and-mouth disease virus, a member of the picornavirus family; aspects of virus protein synthesis, protein processing and structure / G.J. Belsham // Prog. Biophys. Molec. Biol. 1993.-V.60.-P.241-260.
43. Complete protein linkage map of poliovirus P3 proteins: interaction of polymerase 3Dpol with VPg and with genetic variants of ЗАВ / W. Xiang,
45. Conservation of the secondary structure elements of the 5′-untranslated region of cardio- and aphthovirus RNAs / E.V. Pilipenko, V.M. Blinov,
49. Crowther, J.R. The use of non-structural (NS) antigens of FMD virus to assess antibodies in vaccinanted and infected livestock / J.R. Crowther // Foot-and-mouth disease: control strategies: symposium proceedings. — Lyons, 2002.-P. 377.
53. Detection of cattle exposed to foot-and-mouth disease virus by means of an indirect ELISA test using bioengineered nonstructural polyprotein ЗАВС /
59. Differential restrictions on antigenic variation among antigenic sites of foot-and-mouth disease virus in the absence of antibody selection / A. Holguin, J.
69. Dyrting, K.C. Evaluation and use of foot-and-mouth disease virus nonstructural protein ELISA in pigs in Hong Kong / K.C. Dyrting, C.H. Chow, T.M. Ellis // Proceeding of EUFMD Research Group Meeting. — Chania, 2004.-P.45.
104. Kitching, R.P. Identification of foot-and-mouth disease virus carrier and subclinically infected animals and differentiation from vaccinated animals / R.P. Kitching // Rev. Sci. Tech. Off. Int. Epiz. 2002.-V.21.-P.531-538.
106. Kitching, R.P. Problems of diagnosis of foot-and-mouth disease in domestic animals / R.P. Kitching // Foot-and-mouth disease: control strategies: symposium proceedings. — Lyons, 2002. — P. 353-360.
114. Marquardt, О. FMDV protease ЗС lacks linear epitopes for bovine antibodies, while such epitopes are present in 2C and ЗА / О. Marquardt // Report of the Third Annual Meeting, Tubingen, 4-5 March, 1996.
169. The sequence of foot-and-mouth disease virus RNA to the 5′ side of the poly(C) tract / S.E. Newton, A.R. Carroll, R.O. Campbell et al. // Gene. 1985.-V.40.-P. 331-336.
173. Wimmer, E. Genome-linked proteins of viruses / E. Wimmer // Cell. — 19 82.-V.28.-P. 199-201.
Обратите внимание, представленные выше научные тексты размещены для ознакомления и получены посредством распознавания оригинальных текстов диссертаций (OCR). В связи с чем, в них могут содержаться ошибки, связанные с несовершенством алгоритмов распознавания. В PDF файлах диссертаций и авторефератов, которые мы доставляем, подобных ошибок нет.
Digital Science & Education LP, 85 Great Portland Street, First Floor, London, United Kingdom, W1W 7LT
Пептид 2A: два в одном
Пептид 2A: два в одном
Схема генома вируса ящура, а также расположение и аминокислотная последовательность пептида 2A. На правом конце 2A в вирусном белке находится сайт первичного процессинга (разделения длинного полипептида вируса на более короткие молекулы). Пептид 2A, в отличие от «настоящих» протеаз Lpro и 3Cpro, также фрагментирующих первичный полипептид (показано пробелами), работает только во время белкового синтеза, прямо внутри рибосомы.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: В статье рассказывается о механизме действия пептида 2A из вируса ящура, при вставке генетической последовательности которого между последовательностями двух других белков, в любой эукариотической клетке произойдет разделение синтезируемой белковой цепочки на две — прямо во время синтеза полипептида внутри рибосомы. Это свойство 2A применяется в биотехнологии для получения нескольких белков с одной РНК. В наших экспериментах показано, что в таком «расщеплении» принимают участие факторы терминации трансляции.
Конкурс «био/мол/текст»-2011

Скачет зайка по лужайке:
Прыг да скок, прыг да скок,
Ну, а клетка в это время
Синтезирует белок.
Биотеатр Белгосуниверситета
Биосинтез белка
В общих чертах, синтез белка происходит одинаково во всех живых клетках, начиная от бактерий и заканчивая человеком. Для начала нужна инструкция, молекула РНК.
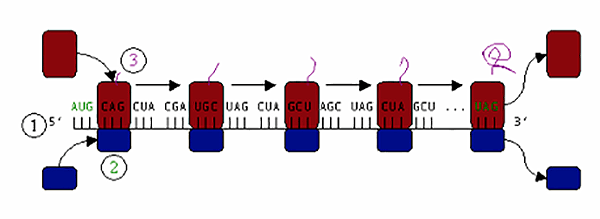
Малая субъединица рибосомы — молекулярной машины для синтеза белка — соединяется с большой субъединицей на стартовой тройке нуклеотидов информационной, или матричной РНК (мРНК) — кодоне AUG. Синтез происходит на интерфейсе между большой и малой субъединицами, где протянута нитка мРНК (рис. 1).
Рисунок 1. Схема синтеза белка. Малая субъединица рибосомы (2) присоединяется к большой (3) и начинает синтез белка (растущая фиолетовая линия) с кодона AUG (1). На стоп-кодоне UAG факторы терминации гидролизуют последнюю тРНК, белок высвобождается, субъединицы разъединяются.
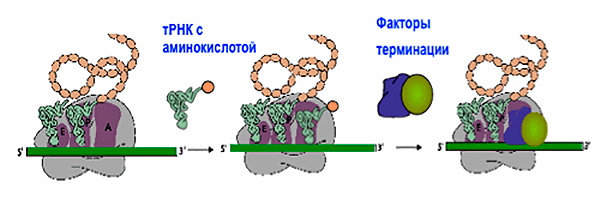
Первая транспортная РНК (тРНК), к которой присоединена аминокислота метионин, узнав «свои» три нуклеотида (кодон) на мРНК, присоединяется к А-сайту рибосомы (рис. 2). Вторая тРНК узнает следующий кодон, который находится в Р-сайте рибосомы, и рибосома катализирует образование пептидной связи между двумя аминокислотами, находящимися «по соседству». После этого рибосома сдвигается на один кодон, первая тРНК отсоединяется от рибосомы, следующая тРНК с присоединенной к ней аминокислотой узнает следующий кодон и присоединяется к Р-сайту. И так далее — быстро, четко, с несколькими проверками качества, которые позволяют убедиться, что правильная аминокислота будет в правильном месте, и что белок будет работать.
Рисунок 2. Схематическое строение рибосомы и ее «рабочий цикл». Рибосома пошагово синтезирует белок, пока не доходит стоп-кодона, когда вместо тРНК в А-сайт присоединяются факторы терминации, катализирующие расщепление связи между белком и последней тРНК.
Синтезируемая цепочка аминокислот направляется в рибосомальный тоннель в большой субъединице, словно нитка через игольное ушкó. До того, как вновь синтезированный полипептид выйдет за пределы рибосомы во внутреннее пространство клетки, полипептидная цепочка будет в длину минимум 30 аминокислот. Белок удлиняется до тех пор, пока в конце мРНК рибосома не встретит кодон, который не узнаёт ни одна тРНК — стоп-кодон. Как титры «The End» означают конец фильма, так и стоп-кодон означает конец синтеза белка.
Процесс прекращения синтеза белка, или терминации, как это ни странно, устроен проще у высших организмов, чем у бактерий. И у человека, и у братьев наших меньших — дрожжей — прекращение синтеза белка зависит от двух белков — факторов терминации 1 (ФТ1) и 3 (ФТ3) (ФТ2 у высших организмов отсутствует — история биологии, как любая история, штука нелогичная). По форме напоминающий букву Г, ФТ1 похож на тРНК. В основании «Г» расположены аминокислоты, которые узнают стоп-кодон, горизонтальная ручка «Г» участвует в гидролизе полипетидной цепочки, освобождая её от последней тРНК. В то время, как ФТ1 служит катализатором, ФТ3 поставляет энергию для гидролиза. Ошибочная терминация, когда факторы терминации присоединяются в середине белка, происходит крайне редко — один раз на один миллион присоединённых аминокислот.
Пептид из вируса рогов и копыт
Этой системой пользуются не только живые организмы, но и нечто не совсем живое — вирусы. Вирусы используют аппарат синтеза белка клетки, которую они заразили, для производства своих белков. Однако они, как и вирусы в компьютере, заставляют рибосомы выпускать несвойственную им продукцию.
Пожалуй, один из самых известных вирусов — вирус ящура, который заражает крупный рогатый скот и человека. Эпидемия ящура в 2007 году нанесла многомиллиардный ущерб британской экономике, а такие эпидемии случаются регулярно.
«Программа» вируса ящура заключена в длинной (около 6 тысяч нуклеотидов) молекуле РНК [1]. Поскольку белки вируса ящура считываются с этой молекулы в виде единого полипептида, который потом разделяется на более короткие фрагменты протеазами, «геном» называется последовательность, которая кодирует белок с самостоятельными функциями. С РНК сначала считываются белки оболочки вируса, потом протеазы, а затем вирусные полимеразы, которые скопируют РНК вируса и с этих копий синтезируют много копий вирусного генома. РНК вируса можно представить в виде телеграммы, которая начинается со «здравствуйте» (одного стартового кодона) и где пропущены слова «ЗПТ» или «ТЧК» — между генами отдельных белков.
Я расскажу о небольшом — в 20 аминокислот — пептиде, который называется 2A.
«Ген» 2A расположен между генами белков оболочки и полимеразами. 20 аминокислот, составляющие 2A, на первый взгляд, не играют никакой роли в воспроизводстве вируса. 2A не участвует в образовании белковой оболочки вирусных частиц и не попадает внутрь ее. Не принимает он участия и в образовании копий нуклеиновой кислоты. Однако у этих 20 аминокислот есть уникальное свойство.
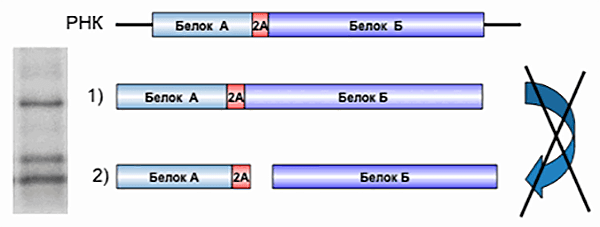
Если ген, кодирующий 2A, вставить в середине какого-либо гена или между двумя генами любых белков, синтезировать соответствующую мРНК и поместить её в любую клетку с ядром или полученный из неё клеточный экстракт, рибосомы этой клетки начинают выпускать довольно странную продукцию. Это будет не один белок с лишними 20 аминокислотами в середине, как это произошло бы с любыми другими 20 аминокислотами, а два отдельных белка. Первый будет оканчиваться 19-ю аминокислотами от 2A справа (на C-конце), а второй всегда будет начинаться с пролина — последней (20-й) аминокислоты 2A (рис. 3).
Рисунок 3. Схематическое действие 2A на синтез белка. «Нормальный синтез» — с одной РНК считывается она полипетидная цепь. При синтезе белков вируса ящура, когда 2A наиболее эффективен, этот продукт не образуется, но при использовании ровно 20 аминокислот этот продукт можно увидеть. 2) Образуется два независимых белка, причем 2A прикреплен к С-концу первого. Продукт «нормального синтеза» никогда не превращается в два независимых полипептида (то есть, это не автокаталитическое расщепление).
Механизм
А ведь белки способны на самомодификацию — не только «саморазрезание», но и «самовырезание» фрагментов из середины: «Белки против РНК — кто первым придумал сплайсинг?» [5]. — Ред.
Первый намек на механизм действия 2A был получен в экспериментах на пекарских дрожжах — тех самых, которые производят хлеб, вино и пиво [2]. Кроме этой полезной деятельности, дрожжи используются во многих молекулярно-биологических экспериментах, поскольку, как и человеческие клетки, содержат ядро, и многие процессы в них протекают сходно. В то же время, дрожжи растут на более простых, а значит, более дешёвых средах, делятся гораздо быстрее человеческих клеток, и существуют масса возможностей генетических манипуляций с ними.
Одна из клеточных органелл, которые есть и у дрожжей, и у человека — эндоплазматический ретикулум (ЭР). Он состоит из окруженной двуслойной липидной мембраной сети каналов, по которым транспортируются различные вещества.
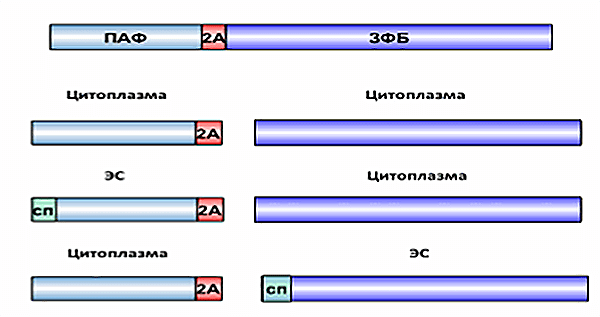
Белки, которые будут транспортироваться по ЭР, синтезируются рибосомами, прикрепляющимися к ЭР со стороны цитоплазмы через белок-рецептор. При этом синтезируемый белок из рибосомального тоннеля сразу поступает внутрь канала ЭР. Это свойство рибосом было использовано для проверки, не разрезает ли белки, содержащие 2A, какая-нибудь клеточная протеаза, потому что к белку, синтезируемому прикрепленной к ЭР рибосомой, у протеазы доступа нет.
Рисунок 4. Схема действия 2A при транспорте белков. Сигнальная последовательность на N-конце белка вызывает транспорт первого, но не второго белка в эндоплазматическую сеть. Условные обозначения: СП — сигнальная последовательность; ПАФ — проальфафактор; ЗФБ — зеленый флуоресцентный белок.
Если сигнальная последовательность, которая должна вызывать транспорт белка в эндоплазматическую сеть, была на первом гене, первый белок с прикрепленным к нему 2A транспортировался в ЭР, а второй белок оставался в цитоплазме. Если только второй белок содержал сигнальную последовательность, в ЭР транспортировался только он. Это означает, что:
Для проверки вероятного участия факторов теминации в реакции, вызываемой 2A, уже упоминавшийся ген-«склейка» ПАФ—2A—ЗФБ экспрессировали в дрожжевых клетках [3]. Оказалось, что в клетках, мутантных по факторам терминации ФТ1 или ФТ3, продукция большого числа молекул 2A приводит к гибели клеток, — вероятно, потому что факторы терминации не могут действовать эффективно на клеточных РНК в присутствие большого числа синтезируемых молекул 2A. Осаждение отдельных частей белка с помощью антител показало, что клетках, мутантных по ФТ1 или ФТ3, а также клетках, в которых образование прионов уменьшает количество активного ФТ3, образуется меньше двух продуктов реакции с 2A и больше — «нормального», не разрезанного, белка. Эти эксперименты показывают, что факторы терминации принимают участие в разделении синтезируемого белка с 2A надвое.
Одним из контрольных экспериментов для подтверждения этой гипотезы было воспроизведение реакции in vitro. В бесклеточных экстрактах было показано, что для прохождения реакции РНК, кодирующей 2A, достаточно было иметь все кодоны, включая кодирующий последнюю аминокислоту 2A, P19 [4]. В этом случае можно видеть, как пептид отделяется от последней тРНК. Последующие кодоны не нужны, то есть достаточно иметь кодон в последнем, А-сайте рибосомы, где обычно присоединяются факторы терминации.
К нашему удивлению, замена кодона для P19 стоп-кодоном привела к остановке реакции, то есть тРНК оставалась прикрепленной к пептиду. Очевидно, в случае «странного пептида 2A» конфигурация рибосомы позволяет факторам терминации либо узнавать стоп-кодон, либо выполнять свою обычную функцию: катализировать отделение тРНК от пептида.
Многие белки человека состоят из нескольких отдельных субъединиц (полипептидов), и для лечения некоторых заболеваний нужно экспрессировать все эти полипептиды одновременно, причем — в равной пропорции. Поскольку 2A предложено использовать в генной терапии для одновременного производства нескольких отдельных белков с одного вектора (вместо использования нескольких векторов), данные эксперименты поднимают пока неотвеченный вопрос о том, что произойдет с клетками человека, в которых 2A продуцируется долго и в больших количествах.
Второй вопрос еще менее изучен: каким образом рибосома остается прикрепленной к мРНК после терминации на 2A, и что позволяет ей начинать синтез второй части белка в отсутствие стартового AUG.