Неполная инволюция вилочковой железы у взрослых что это
Что нужно знать о патологии тимуса
Внутренний секрет
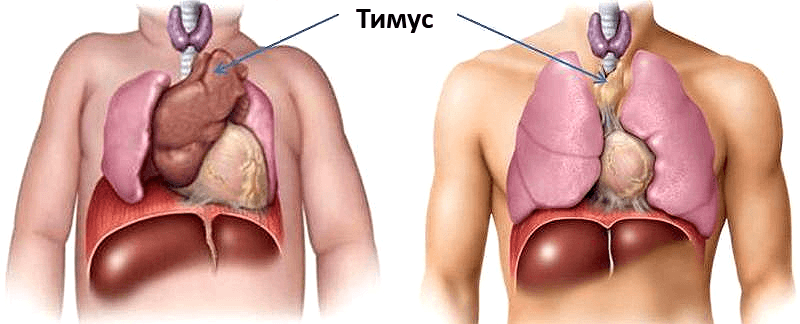
Вилочковая железа — источник популяции тимусзависимых лимфоцитов (Т-лимфоцитов), которые отвечают за распознавание антигенов, регуляцию и другие функции иммунного ответа. Именно в тимусе происходит их клонирование и дифференцировка. Для обеспечения защиты созревающих Т-лимфоцитов от воздействия разнообразных антигенов даже существует гемато-тимусный барьер.
Еще одной особенностью вилочковой железы является ее «недолговечность» — с пубертатного периода начинается инволюция, и у взрослых практически вся железистая ткань заменяется жировой.
Значимость этой железы трудно переоценить. При ее недоразвитии происходит снижение клеточного и гуморального иммунитета, в следствие чего возникают септические осложнения в первую очередь вирусной и грибковой природы. В детском возрасте возможно и увеличение вилочковой железы (тимомегалия), которое часто сопровождается экссудативно-катаральным диатезом, тяжелым и длительным течением бронхолегочных заболеваний. Правда, следует учитывать возможность частого физиологического увеличения вилочковой железы на первом году жизни, которое может наблюдаться почти у половины детей.
Отдельно стоят болезни тимуса у взрослых. В большинстве случаев речь идет о различных опухолях вилочковой железы, которые носят общее название — тимомы. Они являются наиболее частыми новообразованиями средостения (комплекс органов, расположенных между правой и левой плевральными полостями), хотя и составляют менее 1 % всех онкологических заболеваний. Чаще всего встречаются доброкачественные образования (65—70 %), но и они могут доставлять большие проблемы больному. Правда, на начальных стадиях и при медленном росте эти опухоли не сопровождаются какими-либо патологическими симптомами, поэтому выявить их можно только случайно, при компьютерной томографии грудной клетки. Однако значительное увеличение объема патологически измененной вилочковой железы приводит к сдавлению и нарушению функции близлежащих органов. Поскольку тимус расположен в средостении, за грудиной, его ближайшими «соседями» являются трахея, пищевод, сердце, аорта, легочная артерия, большая полая вена и нервные волокна.
Характерные симптомы при развитии опухоли тимуса — затруднение дыхания и глотания, кашель, отеки и цианоз верхней части туловища и лица, боль за грудиной, шум и тяжесть в голове, возможен сбой сердечного ритма. Нарушение работы тимуса, которое возможно даже при доброкачественном течении опухоли, часто приводит к развитию миастении — нарушению функции мускулатуры тела. Это нервно-мышечная патология, которая имеет аутоиммунную природу и сопровождается быстрой слабостью и утомляемостью в первую очередь скелетных мышц. Больному человеку трудно встать со стула, подняться по лестнице, руки становятся «ватными». Усталость нарастает к вечеру: нарушается речь, опускаются веки, появляется двоение в глазах, сложно сфокусировать взгляд. При выраженной симптоматике нарушается процесс жевания и глотания, изменяется голос (становится гнусавым). Характерна связь физической нагрузки одних групп мышц с нарушением других функций мышечной системы. Так, после некоторого усилия слабость ощущается не только в мышцах, которые были задействованы, но и во всех остальных. Для злокачественных опухолей, особенно на поздних стадиях, характерны отдаленные метастазы и нарастающая интоксикация.
Лечение болезни комплексное, после хирургической операции назначается лучевая и химиотерапия. Оперативные вмешательства в настоящее время могут в ряде случаев проводиться эндоскопически (торакоскопия), что позволяет значительно сократить послеоперационный период. Современные методы лечения позволяют вернуть здоровье в 60—90 % случаев в зависимости от степени развития патологии.
Тимома
Клеточные элементы мозгового и коркового слоев, равно как и строма, могут стать источником различных опухолей. Эти опухоли, по данным большинства авторов, чаще располагаются в передневерхнем средостении и известны под названием тимом.
Термин «тимома», предложенный Грандхоуммом еще в 1900 г., объединяет все виды опухолей вилочковой железы и применяется и в настоящее время.
Патогенез (что происходит?) во время Тимомы:
Опухоль обычно небольших размеров, покрыта капсулой, относительно доброкачественная. Однако понятие «доброкачественная тимома» весьма условно, так как в ряде случаев те опухоли, которые при гистологическом исследовании расцениваются как доброкачественные, нередко имеют тенденцию к инфильтративному росту, метастазированию и дают рецидивы после их удаления.
При любом гистологическом типе строения опухоли в толще ее нередко встречаются очаги некроза, кровоизлияния с последующим кистообразованием, фиброзом.
У 10-50% больных с тимомами и задержкой инволюции тимуса выявляются симптомы миастении.
Симптомы Тимомы:
Клиническая картина тимом весьма разнообразна. Около 50% случаев образования опухолей протекает бессимптомно и выявляется во время профилактических рентгенологических исследований или проявляется симптомами сдавливания органов переднего средостения.
При значительном сдавливании появляется чувство стеснения за грудиной, неприятные ощущения и боли, одышка, набухание шейных вен, одутловатость и синюшная окраска лица. Особенно выражены респираторные нарушения у детей вследствие сдавливания относительно узкой податливой трахеи.
В течении болезни можно выделить бессимптомный период и период выраженных клинических проявлений. Длительность бессимптомного периода зависит от локализации и размеров новообразования, его характера (злокачественное, доброкачественное), скорости роста, взаимоотношений с органами и образованиями средостения. Очень часто новообразование длительное время развивается бессимптомно, и его случайно обнаруживают при профилактическом рентгенологическом исследовании грудной клетки.
Клинические признаки новообразований состоят из:
На поздних стадиях развития новообразований возникают: общая слабость, повышение температуры тела, потливость, похудание, которые характерны для злокачественных опухолей. У некоторых больных наблюдаются проявления нарушений, связанных с интоксикацией организма продуктами, выделяемыми растущими опухолями. К ним относится артралгический синдром, напоминающий ревматоидный полиартрит; боли и припухлость суставов, отеки мягких тканей конечностей, нарастание частоты сердечных сокращений, нарушение сердечного ритма.
Таким образом, клинические признаки новообразований тимуса весьма многообразны, однако они проявляются в поздних стадиях развития заболевания и не всегда позволяют установить точный этиологический и топографо-анатомический диагноз. Важным для диагностики являются данные рентгенологических и инструментальных методов, особенно для распознавания ранних стадий заболевания.
Диагностика Тимомы:
Синдромы, сопутствующие тимоме, заставляют начать целенаправленное исследование для обнаружения тимомы, поэтому опухоли раньше выявляются и имеют сравнительно небольшие размеры. Бессимптомно развивающиеся опухоли вилочковой железы достигают значительно больших размеров к моменту обнаружения или появления симптомов сдавления органов средостения. Опухоли размером 3 см в диаметре и меньше выявляются с помощью компьютерной томографии. Быстрое увеличение опухоли при динамическом наблюдении, неровные нечеткие контуры указывают на злокачественный ее характер.
К рентгенологическим методам обследования больного с новообразованием тимуса относятся: рентгеноскопия, рентгенография и томография грудной клетки, контрастное исследование пищевода.
Рентгеноскопия дает возможность выявить патологическую тень, составить представление о ее локализации, форме, размерах, подвижности, интенсивности, контурах, установить отсутствие или наличие пульсации ее стенок. В ряде случаев можно судить о связи выявленной тени с расположенными рядом органами.
Для уточнения полученных при рентгеноскопии данных производят рентгенографию. При этом уточняют структуру затемнения,его контуры, отношение новообразования к соседним органам и тканям. Контрастирование пищевода помогает оценить его состояние, определить степень смещения или прорастания опухолью.
При наличии увеличенных лимфатических узлов надключичных областей проводят их биопсию, что позволяет определить их метастатическое поражение или установить системное заболевание. При наличии компрессионного синдрома производят измерение центрального венозного давления.
Больным с новообразованиями выполняют общий и биохимический анализ крови. При подозрении на эхинококкоз показано определение реакции латексагглютинации с эхинококковым антигеном. Изменения морфологического состава периферической крови обнаруживаются, главным образом, при злокачественных опухолях (анемия, лейкоцитоз, лимфопения, повышенная скорость оседания эритроцитов), воспалительных и системных заболеваниях. При сочетании опухоли с аутоиммунными заболеваниями повышается титр аутоантител против различных антигенов.
Рентгенсемиотика опухолей и кист вилочковой железы. Рентгенологическая семиотика. В прямой проекции по правому или левому Контуру срединной тени выявляется неправильной формы полуовальная тень средней или высокой интенсивности. Уровень расположения этой тени различен, но чаще это верхний или средний отдел срединной тени. Структура затемнения однородна, очертания его обычно бугристые, крупноволнистые, реже гладкие.
Как и при других образованиях, расположенных в непосредственной близости к сердцу и магистральным сосудам, тень тимомы обладает передаточной пульсацией. Исследование в боковой проекции позволяет определить, что затемнение располагается спереди и примыкает к тени грудины. Иногда есть необходимость провести послойную томографию. Особенно демонстративна рентгенологическая картина при пневмомедиастинуме.
Четкие очертания опухоли и отграниченность ее от соседних органов и тканей дают основание предположить доброкачественный вариант тимомы. Злокачественный вариант опухоли вилочковой железы проявляется обычно двусторонним расширением срединной тени с нечеткими бугристыми очертаниями и быстрым увеличением на фоне заметного ухудшения общего состояния больных.
Дифференциальная диагностика. От загрудинного зоба тимома отличается отсутствием связи с областью шеи и наличием отчетливо выявляемой верхней границы; тень опухоли не смещается кверху при глотании.
От дермоидов и тератоидов, располагающихся в этом же отделе средостения, тимому отличают бугристые очертания. Для тератодермоидов типично наличие ровных очертаний и правильной овоидной формы, что для тимомы исключение.
Лечение Тимомы:
В противном случае может быть рецидив опухоли и рецидив миастении. Операции выполняются трансстернальным доступом, который позволяет произвести хорошую ревизию и удалить опухоль, вилочковую железу и прилежащую жировую клетчатку переднего средостения. Если при гистологическом исследовании опухоль оказывается злокачественной, после операции больного (после снятия с раны операционных швов) необходимо перевести в специализированное онкологическое учреждение для химио-и лучевого лечения.
Ранний послеоперационный период у больных миастенией с опухолью вилочковой железы протекает тяжелее, чем у больных с гиперплазией железистой ткани.
Чаще наблюдается миастенический криз, требующий многодневной искусственной вентиляции легких, трахеотомии, интенсивной терапии, включая современные методы детоксикации и др.
Лучевая терапия вилочковой железы до операции проводится больным пожилого возраста с сопутствующими заболеваниями, так как риск операции у них слишком высок. В дальнейшем, может быть, некоторым из них при улучшении общего состояния удастся выполнить радикальную операцию. Большинству же в оперативном лечении приходится отказывать.
Определенный лечебный эффект оказывают ингибиторы холинэстеразы: галантамин (по 1 мл 1%-ного водного раствора), прозерин (по 1 мл 0,05%-ного раствора). Глюкокортикоиды дают временный эффект.
К каким докторам следует обращаться если у Вас Тимома:
Наивные Т-клетки — ключ к долголетию
Наивные Т-клетки — ключ к долголетию
Автор
Редактор
Статья на конкурс «био/мол/текст»: Наивные Т-лимфоциты могут поведать о том, что вы хотели бы скрыть. Впервые было осуществлено секвенирование профиля Т-клеточных рецепторов периферической крови человека. Успехи в развитии технологий секвенирования нового поколения дают возможность проследить за динамикой колебаний численности и разнообразия наивных Т-клеток по мере старения организма. Вместе с этими знаниями появляется ответ на вопрос, почему женщины живут дольше мужчин, и приходит мысль о том, что увеличить продолжительность жизни можно, используя собственные Т-клетки. «Иммунологические часы» несложно обмануть, пойдя на хитрость.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Всегда ли можно дать сорокалетнему мужчине его сорок? А пятидесятилетнему? А скольким тридцатилетним женщинам вы бы не дали двадцати? Определять возраст человека по внешней составляющей не самая лёгкая задача. Однако, людям, перешагнувшим определённый порог, различный для мужчин и женщин, когда репродуктивная функция начинает стремительно угасать, становится сложнее скрывать свой возраст.
Для внутренних процессов человеческого организма характерны совершенно иные темпы изменений. «Возрастной порог» нашей иммунной системы расположен гораздо ближе к детству, чем к старости. Уже с первого года жизни в тимусе ребёнка начинают происходить драматические изменения: функциональная ткань органа заменяется на соединительную, уменьшаясь каждый год на 3% до 35–45 лет, а после 45 — на 1% (рис. 1). В 70 лет соединительная ткань занимает 90% тимуса [1]. Наиболее активно тимус функционирует в пренатальный период и до наступления половой зрелости. За это время происходит наработка максимальных возможностей Т-клеточного иммунитета, что будет во многом определять эффективность иммунного ответа человека на протяжении всей его жизни.
Рисунок 1. Сравнение размеров тимуса у новорождённого (а) и взрослого (б). К 50 годам тимус уменьшается в 5-7 раз по сравнению с первоначальным размером. Рисунок с сайта my.bpcc.edu.
Тимус — военная база иммунной системы
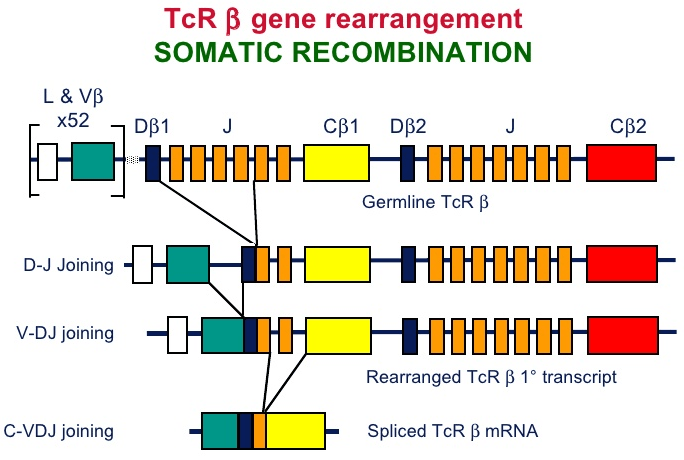
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус. В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2). Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3). Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 10 5 возможных вариантов на каждые 10 6 Т-клеток [2]. В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов. Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR. Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента. Рисунок с сайта Slideshare.
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя). б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном. С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену. Рисунок с сайта Genomemedicine.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне. Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз. Но это разнообразие остаётся константным только некоторое время.
Мы теряем наших бойцов!
По результатам последних исследований [2], доля наивных Т-клеток как в CD4 + (Т-хелперы) так и в CD8 + (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50–80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия. Авторы исследования [2] создали новый подход к использованию технологии секвенирования нового поколения компании Illumina для получения наиболее точных индивидуальных профилей репертуара TCR у людей различных возрастных групп. Было показано, что разнообразие TCR в периферической крови человека коррелирует с процентным содержанием в ней наивных Т-клеток и почти линейно уменьшается с возрастом — примерно на 5 × 10 3 вариантов TCR в год. Наивные Т-клетки сосуществуют в крови с Т-клетками памяти, клоны которых образуются в результате пролиферации наивных Т-клеток, повстречавших «свой» антиген. Размножившиеся клоны с каждым годом занимают всё большую долю доступного для пролиферации пространства в крови, это отражается на численности наивных Т-клеток, так как общее количество Т-клеток в крови человека относительно стабильно.
* — Но не стоит забывать, что кроме популяций в периферической крови, у человека есть гораздо более мощная локальная армия Т-лимфоцитов «на местах»: «Т-лимфоциты: путешественники и домоседы» [4]. — Ред.
Общее разнообразие TCR определяется количеством редких клонов в пуле Т-клеток, поэтому отсутствие возрастных изменений в разнообразии наиболее многочисленных Т-клеточных клонов указывает на то, что клоны наивных Т-клеток теряются с возрастом. Это связано с тем, что клоны наивных Т-клеток обычно малочисленны, поэтому вероятность того, что ни одна клетка данного клона не сможет поделиться или погибнет в результате каких-то случайных событий гораздо выше, чем для клонов с большим числом клеток.
Старики с высоким разнообразием TCR
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4 + периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ [2].
Долгая, но бездетная жизнь
Рисунок 4. Придворные евнухи в Китае. Некоторые евнухи жили более ста лет. Рисунок с сайта Lacasamundo.
Исследование о придворных евнухах династии Чозунь в Корее 2012 года [6] показало, что продолжительность жизни евнухов составляла на 15–20 лет больше, чем продолжительность жизни мужчин с нормальной репродуктивной функцией, живущих в тех же условиях (рис. 4). Возможно, их продолжительность жизни увеличивалась именно благодаря отсутствию инволюции тимуса под влиянием половых гомонов, а следовательно благодаря большему разнообразию TCR наивных Т-клеток. В пользу этой гипотезы можно привести данные о том, что у женщин производство тимусом наивных Т-клеток происходит более эффективно, чем у мужчин, и уменьшение их содержания в периферической крови у женщин выражено в меньшей степени, чем у мужской части населения [7]. Возможно, лучшая работа иммунной системы у женщин связана с тем, что во время беременности иммунитет женщины необходимо «обуздать», сделав его толерантным к фактически чужеродному телу — плоду, что требует участия сложных регуляторных путей. Высокая точность регуляции иммунного ответа очень важна, так как ошибка приведёт к потере потомства. К этим рассуждениям можно прибавить и тот факт, что у женщин с наступлением менопаузы яичники перестают вырабатывать эстрогены, а у мужчин выработка половых гормонов не прекращается. Это объясняет большую продолжительность жизни у женщин, чем у мужчин, характерную для любых национальностей. В Европе и США женщины живут дольше мужчин на 4,5–5 лет, в России — на 13 [6].
Мальчик, которому сделают орхеэктомию (удаление яичек), может быть, и получит дополнительные 10–15 лет жизни, вместе с тем лишившись возможности иметь детей и получив набор других не совсем приятных последствий. Существуют менее радикальные решения, основанные на приёме определённых препаратов, способствующих восстановлению функции тимуса. Одно из таких веществ — грелин, этот гормон вырабатывается слизистой оболочкой желудка и вызывает чувство голода, действуя на центры гипоталамуса. Оказалось, что грелин участвует в Т-клеточном сигналлинге, способен снижать связанное с возрастными изменениями воспаление, способствует восстановлению структуры тимуса и стимуляции его функций. Ряд цитокинов и факторов роста (интерлейкины 7 и 22, фактор роста кератиноцитов) являются потенциальными кандидатами для решения проблемы восстановления функции тимуса у взрослых людей. Интерлейкины обеспечивают дифференцировку и выживание тимоцитов. Фактор роста кератиноцитов необходим для пролиферации и дифференцировки функциональных тканей тимуса, его использование вызывает пролиферацию тимоцитов и увеличивает размеры органа. Возможно также использование веществ, блокирующих выработку стероидных гормонов, таких как аналоги гонадотропин-релизинг гормона, например, люпрона. Люпрон действует на гипофиз, блокируя рецепторы к гонадотропин-релизинг гормону, из-за чего уменьшается выработка лютеинизирующего и фолликуло-стимулирующего гормонов, что ведёт к снижению продукции эстрогена и тестостерона. И всё же, все вышеперечисленные вещества имеют неоднозначное воздействие на организм, и пока ещё нет данных о долгосрочных последствиях их приёма, поэтому их назначают только в случае восстановления после химиотерапии или при ВИЧ-инфекции, когда стимуляция работы тимуса необходима для реконституции иммунной системы [1].
Хранение наивных Т-клеток — полезная инвестиция в будущее
Есть ли иной способ продлить мужскую жизнь? Авторов статьи [2] посетила смелая идея решения этой проблемы. Кроме того, что редко встречающиеся клоны наивных Т-клеток в результате случайных событий теряются с возрастом, они, как и все клетки организма, могут поделиться лишь ограниченное количество раз (примерно 50 — лимит Хейфлика), что обусловлено укорочением теломерных участков хромосом после каждой репликации ядерной ДНК, а делятся наивные Т-клетки раз в 1–2 года. Значит примерно к 70 годам основная часть Т-клеток выйдет из строя. Решение есть — можно запасать наивные Т-клетки! У молодых людей в возрасте до 15–20 лет, когда процессы формирования основного пула наивных Т-клеток уже заканчиваются, нужно брать образцы крови в таком объёме, чтобы количества наивных Т-клеток в них хватило для полного восстановления их пула уже в пожилом возрасте, и заморозить. Очень важно, чтобы забор произошёл именно в этот промежуток времени. Если брать кровь у более взрослых людей, количества циркулирующих наивных Т-клеток просто не хватит для полной реставрации их пула в будущем. Конечно же, такой подход будет эффективен и для женского пола. Эти образцы крови будут не только средством продления жизни, но ещё и подстраховкой в случае аутоиммунных заболеваний или рака, они помогут восстановить иммунную систему после химиотерапии. Создание подобных банков с замороженными образцами крови стало бы ключевым событием в становлении абсолютно новых подходов к лечению заболеваний иммунной системы. Например, СПИД можно было бы вылечить введением в здоровые размороженные Т-клетки заразившегося СПИДом мутации по гену мембранного рецептора CCR5 (CD195), люди с такой мутацией обладают природной резистентностью к ВИЧ [8], и их пересадкой больному, предварительно прошедшему курс химиотерапии.
Итоги
Как бы молодо не выглядел человек, параметры его иммунной системы будут объективно отражать возраст. Такие параметры как количество наивных Т-клеток и разнообразие TCR практически линейно снижаются по мере старения. Если вы являетесь счастливым обладателем повышенного разнообразия TCR, можете надеяться на несколько бонусных лет жизни. В будущем человечество ожидают новые дерзкие подходы к увеличению продолжительности жизни с использованием собственных наивных Т-лимфоцитов, собранных и замороженных много лет назад.