Неорганика это что такое
Неорганическая химия
Неоргани́ческая хи́мия — раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических веществ (класса соединений, в которые входит углерод, за исключением нескольких простейших соединений, обычно относящихся к неорганическим [1] ). Различие между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными. [2] Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений). Обеспечивает создание материалов новейшей техники. Число неорганических веществ приближается к 400 тысячам.
Теоретическим фундаментом неорганической химии является периодический закон и основанная на нём периодическая система Д. И. Менделеева. Важнейшая задача неорганической химии состоит в разработке и научном обосновании способов создания новых материалов с нужными для современной техники свойствами.
В России исследованиями в области неорганической химии занимаются Институт неорганической химии им. А. В. Николаева СО РАН (ИНХ СО РАН, Новосибирск), Институт общей и неорганической химии им. Н. С. Курнакова (ИОНХ РАН, Москва), Институт физико-химических проблем керамических материалов (ИФХПКМ, Москва), Научно-технический центр «Сверхтвердые материалы» (НТЦ СМ, Троицк) и ряд других учреждений. Результаты исследований публикуются в журналах («Журнал неорганической химии» и др.).
Содержание
История определения
Исторически название неорганическая химия происходит от представления о части химии, которая занимается исследованием элементов, соединений, а также реакций веществ, которые не образованы живыми существами. Однако со времен синтеза мочевины из неорганического соединения цианата аммония (NH4OCN), который совершил в 1828 году выдающийся немецкий химик Фридрих Вёлер, стираются границы между веществами неживой и живой природы. Так, живые существа производят много неорганических веществ. С другой стороны, почти все органические соединения можно синтезировать в лаборатории. Однако деление на различные области химии является актуальным и необходимым, как и раньше, поскольку механизмы реакций, структура веществ в неорганической и органической химии различаются. Это позволяет проще систематизировать методы и способы исследования в каждой из отраслей.
Классификация химических элементов
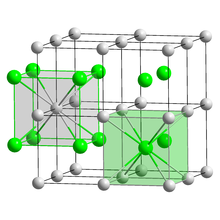
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен [3] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и так далее). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Простые вещества
Состоят из атомов одного химического элемента (являются формой его существования в свободном состоянии). Все простые вещества в неорганической химии делятся на две большие группы: Металлы — Неметаллы.
Металлы
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. Из 118 [4] химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
Таким образом, к металлам относится 96 элементов из всех открытых.
Неметаллы
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их бо́льшую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов. К неметаллам также относят водород и гелий.
Сложные вещества
Большую часть сложных неорганических веществ (то есть состоящих из двух и более химических элементов) можно разделить на следующие группы:
Оксиды
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом.
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония 


Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостей или по-другому «жидких солей», органических солей с температурой плавления ниже 100 °C.
Основания
Основа́ния — класс химических соединений:
Кислоты
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Также можно выделить следующие группы неорганических веществ: карбиды, нитриды, гидриды, интерметаллиды и другие, которые не укладываются в приведённую выше классификацию (более подробно см. Неорганическое вещество).
Карбиды
Карби́ды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения, в которых углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и тому подобные). Карбиды — тугоплавкие твёрдые вещества: карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Нитриды
Нитри́ды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4). Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Гидриды
Интерметаллиды
Интерметалли́д (интерметаллическое соединение) — химическое соединение из двух или более металлов. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами. Интерметаллиды обладают, как правило, высокой твёрдостью и высокой химической стойкостью. Очень часто интерметаллиды имеют более высокую температуру плавления, чем исходные металлы. Почти все интерметаллиды хрупки, так как связь между атомами в решётке становится ковалентной или ионной (например, в ауриде цезия CsAu), а не металлической. Некоторые из них имеют полупроводниковые свойства, причём, чем ближе к стехиометрии соотношение элементов, тем выше электрическое сопротивление. Никелид титана, известный под маркой «нитинол», обладает памятью формы — после закалки изделие может быть деформировано механически, но примет исходную форму при небольшом нагреве.
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Неорганическая химия— раздел химии, который связан с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Эта область химии охватывает все соединения, за исключением органических веществ (класса соединений, в которые входит углерод, за исключением нескольких простейших соединений, обычно относящихся к неорганическим). Различия между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными. Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических). Число известных сегодня неорганических веществ приближается к 500 тысячам.
Теоретическим основанием неорганической химии является периодический закон и основанная на нём периодическая система Д. И. Менделеева. Главной задачей неорганической химии является разработка и научное обоснование способов создания новых материалов с нужными для современной техники свойствами.
Классификация химических элементов
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, которая устанавливает зависимость различных свойств химических элементов от заряда атомного ядра. Система — это графическое выражение периодического закона, который был составлен русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и назывался «Естественная система элементов», который устанавливал зависимость свойств химических элементов от их атомной массы. Всего предложено несколько сотен вариантов изображения периодической системы, но в современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в некоторой степени подобные друг другу.
Простые вещества
Они состоят из атомов одного химического элемента (являются формой его существования в свободном состоянии). В зависимости от того, какова химическая связь между атомами, все простые вещества в неорганической химии разделяются на две основные группы: металлы и неметаллы. Для первых характерна металлическая связь, для вторых — ковалентная. Также выделяются две примыкающие к ним группы — металлоподобных и неметаллоподобных веществ. Существует такое явление как аллотропия, которое состоит в возможности образования нескольких типов простых веществ из атомов одного и того же элемента, но с разным строением кристаллической решетки; каждый из таких типов называется аллотропной модификацией.
Металлы
Металлы (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. Из 118 химических элементов, открытых на данный момент, к металлам относят:
Таким образом, к металлам относится 96 элементов из всех открытых.
Неметаллы
Неметаллы — химические элементы с типично неметаллическими свойствами, занимающие правый верхний угол Периодической системы элементов. В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в соединениях: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По содержанию в земной коре неметаллы существенно различаются. Самыми распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, йод. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их бо́льшую способность для присоединения дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Сложные вещества
Большую часть сложных неорганических веществ (то есть состоящих из двух и более химических элементов) можно разделить на следующие группы:
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
ПРОПИЛЕНГЛИКОЛЬ (пропандиол)
С 3 Н 6 (ОH) 2 стандарта USP,
с содержанием основного вещества 99,9%
от Дистрибьютора компании BASF Германия
Синонимы: Монопропиленгликоль, 1,2 пропиленгликоль.
1,2 пропандиол. Пищевая добавка Е1520
Глицерин USP
(499) 308-44-93
(499) 308-44-91
elena@sintezht.ru
Что такое неорганическая химия?
Неорганическая химия описывает свойства и поведение неорганических соединений, включая металлы, минералы и металлоорганические соединения. В то время как органическая химия изучает все углеродсодержащие соединения, к неорганической относятся оставшиеся подмножества других соединений. Существуют также вещества, которые изучаются сразу обоими разделами химии, например, металлоорганические соединения, которые содержат металл или металлоид, связанный с углеродом.
Неорганическую химию можно разделить на несколько подразделов:
Где применяется неорганическая химия?
Неорганические соединения используются в качестве катализаторов, пигментов, покрытий, поверхностно-активных веществ, лекарственных препаратов, топлива и прочих продуктов, которыми мы пользуемся каждый день. Они часто имеют высокие температуры плавления и конкретные высокие или низкие электрические свойства проводимости, которые делают их полезными для определенных целей.
Неорганическая химия является весьма практичной научно-бытовой отраслью. Особенно для экономики страны имеет значение производство серной кислоты, которая является одной из наиболее важных элементов, используемых в качестве промышленного сырья.
Что изучают в неорганической химии?
Специалисты в области неорганической химии имеют широкий спектр областей деятельности, от добычи сырья до создания микрочипов. Их работа основана на понимании поведения и поиска аналогов неорганических элементов. Главная задача узнать, как эти материалы могут быть изменены, разделены и использованы. Работа неорганических химиков включает в себя разработку методов для восстановления металлов из отходов и анализ добытых руд на молекулярном уровне. Общий акцент делается на освоение связей между физическими свойствами и функциями.
Индивидуальный подход к ценообразованию для каждого клиента!
Для получения информации о ценах на монопропиленгликоль звоните нам по телефонам: +7 (499) 308-44-93, +7 (499) 308-44-91.
Неорганическая химия
Оглавление
История неорганической химии
В последующие годы поиск новых химических элементов, определение их точного относительного атомного веса и их характеристики посредством реакций с другими веществами были среди задач химиков-неоргаников.
Неорганические вещества
Металлы
Металлы используются в качестве батарей и аккумуляторов для выработки электроэнергии. В недорогих углеродно-цинковых батареях цинк окисляется до соли цинка во время подачи электричества. Другими важными батареями являются никель-металлогидридные батареи (перезаряжаемые), литиевые батареи (очень легкие батареи) или недорогие свинцово-свинцовые аккумуляторы (перезаряжаемые).
Металлы или ионы металлов действуют как катализаторы в реакциях в газовой фазе или в жидкости, например, железо в аммиаке или ионы алюминия при синтезе полиэтилена.
Соли, минералы
Водой является важной тканью неорганической химии, он имеет ковалентные связи между поляризованными атомами и может вместить многие неорганические соли хорошо растворяются. Температурный диапазон между точками замерзания и кипения воды обеспечивает жизнь на нашей планете благодаря растворимости неорганических и органических веществ в жидкой воде.
Катионы металлов также встречаются в горных породах и минералах. Металлы в горных породах часто находятся в форме силикатов, которые совсем не растворяются в воде. В дополнение к очень сильным кислотам неорганические соединения также используют переваривание соды для растворения составляющих горных пород.
Стекло : если кварцевый песок нагреть до 1000 ° C, добавив соду, получается стекло.
Плохо растворимые соли использовались и используются в качестве пигментов для окрашивающих красок.
кислоты и основания
Очень важными неорганическими кислотами являются:
Важными неорганическими основаниями являются:
Многие превращения неорганических материалов связаны с выделением газов. Во время электролиза воды выделяются водород и газообразный кислород.
разнообразный
Теория поля лигандов описывает пространственную координацию. С помощью магнитохимии и цвета раствора химики-неорганики могут сделать выводы о координации таких комплексов. В перманганат-анионе ион марганца (VII) имеет четыре атома кислорода в качестве лиганда. Хорошо окрашенный комплекс перманганата калия используется для количественного определения содержания при титриметрии.
Органические кислоты, такие как ЭДТА (количественное определение щелочноземельных ионов), винная кислота или лимонная кислота (с медью (II) в качестве раствора Фелинга или реагентом Бенедикта для определения окисляемых сахаров), а также диоксимы ( диацетилдиоксим для определения никеля) часто являются подходит в качестве красящих лигандов (точнее хелатов ) катионов.
Неорганические реакции
Примером направленной равновесной реакции из-за выходящих газов является превращение хлорида аммония с раствором гидроксида натрия в летучий аммиак :
Такие реакции также играют важную роль в аналитической химии.
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ