Неонатальный аспирационный синдром что это
Синдром аспирации мекония
Синдром аспирации мекония – состояние острой дыхательной недостаточности вследствие внутриутробного попадания в легкие ребенка мекониальных масс с закупоркой просвета бронхов. Характерен синюшный оттенок кожи с рождения, тяжелое шумное дыхание с западением уступчивых мест груди. Состояние расценивается как тяжелое. Синдром аспирации мекония диагностируется на основании внешних признаков дыхательной недостаточности, физикального осмотра и рентгенографической картины. Лечение комплексное, направлено на механическое очищение бронхиального дерева, усиленную оксигенацию и борьбу с инфекционными осложнениями.
Общие сведения
Синдром аспирации мекония – поражение легких новорожденного с высокой вероятностью летального исхода. Смертность достигает 10%, связана с массивной аспирацией мекониальных масс и развитием септического состояния. Частицы первородного кала определяются в амниотической жидкости у 5-20% рожениц, однако заболевание возникает не всегда. Синдром аспирации мекония встречается с частотой около 2-4%. Обычно развивается у доношенных и переношенных детей, у недоношенных встречается реже в связи с особенностями нервной системы, практически исключающими пассаж мекония в околоплодные воды. Является одной из важнейших проблем современной педиатрии в связи с многофакторностью развития и трудностями терапии. В частности, нередко необходимо длительное нахождение ребенка на ИВЛ, что может служить дополнительной причиной развития резистентных к лечению пневмоний.
Причины синдрома аспирации мекония
Хотя этиология состояния продолжает изучаться, большинство исследователей склоняются к гипоксической природе синдрома аспирации мекония. Недостаток кислорода, который возник внутриутробно или в процессе родов, рефлекторно повышает тонус парасимпатической нервной системы. Одновременно происходит централизация кровоснабжения, то есть перераспределение крови с преимущественной циркуляцией в жизненно важных органах (сердце, легкие, мозг) в ущерб всем остальным органам и системам, в том числе кишечнику. Эти два фактора в сумме приводят к гипоксии сосудов брыжейки и рефлекторному расслаблению гладкой мускулатуры кишечника. Как следствие, происходит пассаж первородного кала в околоплодные воды с дальнейшим попаданием в легкие.
Существует большое количество возможных причин гипоксии. Чаще всего дефицит поступления кислорода связан с патологией плаценты, поскольку именно плацентарный кровоток является источником кислорода во внутриутробном периоде развития. Как правило, речь идет о хронической фетоплацентарной недостаточности, обусловленной соматическими заболеваниями матери (в частности, сахарным диабетом и артериальной гипертензией), патологией сосудов плаценты и т. д. Второй вариант – это патологии пуповины или механическое сдавление дыхательных путей (обвитие), что также запускает описанные выше механизмы, приводящие к появлению мекония в околоплодных водах. Определенную роль играет большой вес плода и малое количество амниотической жидкости.
Симптомы и диагностика синдрома аспирации мекония
Синдром аспирации мекония может развиваться с первых минут жизни или спустя несколько часов и даже дней после периода мнимого благополучия. Во многом это зависит от того, как долго малыш испытывал гипоксию, находясь в утробе матери. При раннем появлении симптомов ребенок начинает испытывать трудности с дыханием сразу после рождения. Малыш тяжело и шумно дышит, заметно западение надключичных ямок, межреберных промежутков и других уступчивых мест грудной клетки. Внешне ребенок цианотичный, беспокойный, в тяжелых случаях нервная система, наоборот, угнетена, и пациент выглядит заторможенным. При отсроченном начале синдрома аспирации мекония наблюдаются те же симптомы, но время их возникновения приходится на более поздний период.
Первичная диагностика возможна еще в процессе планового обследования во время беременности. Кардиотокография плода отчетливо показывает затруднение дыхания малыша, в подобных случаях необходимо дальнейшее обследование и поиск причин гипоксии, в частности – анализ амниотической жидкости для выявления в ней частиц мекония. Возможно решение вопроса о досрочном родоразрешении. В процессе интранатальной диагностики синдрома аспирации мекония обращает на себя внимание зеленоватый цвет околоплодных вод, иногда частицы мекония удается визуализировать. Также часто наблюдается зеленоватый цвет ногтей, кожи и пуповины малыша, что, как правило, свидетельствует в пользу длительной внутриутробной гипоксии и тяжелого течения синдрома аспирации мекония.
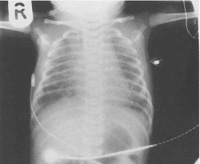
Аускультативно педиатр прослушивает разнокалиберные хрипы, при перкуссии легких участки приглушения чередуются с участками с коробочным звуком. Данные физикального осмотра подтверждаются рентгенографически. На снимке определяются участки ателектаза (спадания альвеол) и эмфиземы (патологического расширения дистальных отделов легких). Такая картина является следствием механической закупорки частицами мекония просвета мелких бронхов, а также вторичного воспалительного процесса, обусловленного токсичностью мекониальных масс. В тяжелых случаях на рентгенограмме обнаруживается так называемая «снежная буря», когда почти вся поверхность альвеол спадается, и остается множество эмфизематозно расширенных участков, неспособных обеспечить циркуляцию воздуха.
Лечение синдрома аспирации мекония
Если синдром аспирации мекония диагностируется еще до родов, то уже в процессе родоразрешения, когда рождается головка, необходимо произвести отсасывание специальным катетером Де Ли. Одна только эта манипуляция, выполненная как можно раньше, позволяет частично освободить верхние дыхательные пути и значительно улучшить оксигенацию. После рождения пациентам с синдромом аспирации мекония проводится лаваж (введение физиологического раствора в трахею с последующим отсасыванием до чистого отделяемого). При наличии выраженной дыхательной недостаточности показано подключение новорожденного к системе ИВЛ.
Важно учитывать, что к моменту подключения ИВЛ легкие должны быть очищены, поскольку в противном случае возможно продвижение оставшихся частиц мекония в дистальные отделы с последующим усугублением дыхательной недостаточности. С целью более быстрого расправления участков ателектаза назначается сурфактант, иногда – оксид азота. Обязательно применение антибиотиков, поскольку частым осложнением синдрома аспирации мекония является аспирационная пневмония. В наиболее тяжелых случаях выполняется экстракорпоральная мембранная оксигенация. Все манипуляции проводятся в отделении реанимации.
Прогноз и профилактика синдрома аспирации мекония
Основным фактором, провоцирующим развитие синдрома аспирации мекония, является внутриутробная гипоксия, поэтому все профилактические мероприятия проводятся в период беременности. Необходима своевременная диагностика и лечение фетоплацентарной недостаточности и соматических заболеваний матери. Стоит избегать перенашивания, которое также повышает риск синдрома аспирации мекония. Прогноз заболевания неблагоприятный. Летальность составляет 10%, выжившие дети в дальнейшем часто имеют хронические легочные патологии. Возможно отставание в развитии вследствие длительной гипоксии.
Синдром аспирации мекония у новорожденных
Общая информация
Краткое описание
Российская ассоциация специалистов перинатальной медицины (РАСПМ)
Год утверждения: 2017 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Околоплодные воды могут быть окрашены меконием в 8-20% всех родов [1, 2, 8, 9]. Причем после полных 42 недель частота достигает 23-52% [10, 11]. От 2 до 9% новорожденных, у которых воды были окрашены меконием, в последствие отмечается клиническая картина САМ [2, 12, 13]. Около трети новорожденных с САМ требуют интубации трахеи и механической вентиляции легких [13]. Летальность при САМ в связи с тяжелыми повреждениями паренхимы легких и развитием легочной гипертензии может превышать 20%. Другие осложнения, включая СУВ, встречаются у 10-30% детей с САМ [14].
Диагностика
Диагностика
— курение, наркомания (особенно, кокаин) [2].
Комментарии: Необходимо проводить дифференциальный диагноз с врожденной пневмонией.
Дифференциальный диагноз
— Транзиторным тахипноэ новорождённых и другими состояниями, сопровождающимися развитием дыхательной недостаточности в раннем неонатальном периоде.
Лечение
Рекомендуется дифференцированный подход к оказанию помощи в родильном зале новорожденным с околоплодными водами, содержащими меконий [26]. Акушеры должны заранее предупредить врачей-неонатологов, если околоплодные воды окрашены меконием и имеются признаки дистресса плода. Санация ротоглотки после рождения головки плода не снижает вероятности развития респираторного дистресс-синдрома или клинически выраженного синдрома мекониальной аспирации, включая подгруппы, где имело место наличие густого мекония, отмечались признаки дистресса у плода или родоразрешение выполнялось абдоминальным путем [19].
Комментарии: В случае отсутствия лаважа желудка в родильном зале при наличии мекония в околоплодных водах не зарегистрировано вторичных осложнений, связанных с регургитацией и/или аспирацией мекониального желудочного содержимого [29]. В то же время лаваж желудка рассматривается как потенциально опасная манипуляция, поскольку введение рото- или назогастрального зонда в родильном зале нередко сопровождается развитием апноэ и/или брадикардией [30].
Неонатальный аспирационный синдром что это
О.А. Рогова, М.Д. Бакрадзе, Л.М. Кузенкова, Е.В. Увакина, К.А. Казакова
ФГБУ Научный центр здоровья детей МЗ РФ, Москва
Введение
Патология бронхов и легких, связанная с хронической аспирацией пищи, занимает значительное место у детей грудного и раннего возраста [1]. Как правило, развитие респираторных жалоб у детей грудного возраста связывают с гастроэзофагеальным рефлюксом (ГЭР) [2–3]. Однако в возникновении бронхолегочной патологии аспирационного генеза первостепенную роль играет дисфагия, а ГЭР имеет второстепенное значение, поскольку его распространенность наблюдалась практически с одинаковой частотой у детей с аспирационным синдромом и без него [4, 5]. В литературе наиболее часто эта проблема описывается у пациентов с сопутствующей патологией центральной нервной системы, а также с синдромом Сандифера [6–8]. Кроме того, по мнению некоторых авторов, с дисфагией связан угрожающий жизни эпизод [9–11]. Роли аспирации у детей без неврологической патологии посвящены отдельные работы [5, 12]. Средняя частота аспирационного синдрома (АС), по данным разных авторов, колеблется от 2 до 3% [13–15]. Однако истинная частота дисфагии и аспирации не известна, поскольку их клинические проявления бывают довольно стерты [1].
Акт глотания – сложный процесс, состоящий из 4 последовательных фаз, которые регулируются 5 парами черепных нервов и в котором участвуют 26 мышц. Губы, глотка, гортань, пищевод совершают координированную работу для его осуществления. Любые анатомические, неврологические или физиологические дефекты могут приводить к аспирации [16]. Перстнеглоточная дисфункция, дискоординация у новорожденных и преходящая дисфункция глоточных мышц достаточно хорошо описаны в педиатрической литературе [1]. Она включает спазм перстнеглоточной мускулатуры или ахалазию верхнего пищеводного сфинктера и встречается у детей, имеющих нормальный сосательный рефлекс, но некоординированный акт глотания. Такое возможно при вторичной задержке глотательного рефлекса или может быть ассоциировано с церебральным параличом [5].
В отечественной литературе недостаточно данных о частоте аспирационной пневмонии у детей раннего возраста. Некоторые зарубежные исследования показали, что 5–15% из 4,5 млн внебольничной пневмонии – аспирационного генеза [17]. По данным проведенного ретроспективного обзора, 30-дневная летальность от аспирационной пневмонии составляет 21% [18]. У пациентов с СА высок риск тяжелых респираторных последствий и, возможно, смерти. У пациентов с массивной аспирацией смертность составляет 25% [19]. В публикациях отечественных исследователей отсутствуют данные о частоте аспирационных процессов и дисфагии у детей, о различиях клинической картины у детей с патологией центральной нервной системы и без нее и о рациональных подходах к терапии.
Целью настоящего сравнительного наблюдательного исследования стало изучение частоты аспирационных процессов у детей с респираторными жалобами; сравнительное изучение клинической картины у детей с привычной аспирацией пищи с детьми, имеющими неврологическую симптоматику; оценка эффективности комплекса мер по борьбе с аспирацией.
В основную группу включали детей с острым поражением нижних дыхательных путей (острый бронхит, бронхиолит, пневмония) в возрасте до 3 лет, у которых не было выявлено неврологической патологии, кроме дисфагии вследствие морфофункциональной незрелости. В группу сравнения включены дети с аспирацией, госпитализированные с органическим поражением центральной нервной системы, имеющие бульбарный или псевдобульбарный синдром. Всем детям проведен физикальный осмотр, забор капиллярной или венозной крови, выполнена проба с кормлением жидкой пищей и аускультацией до и после кормления, осуществлены рентгенограммы органов грудной клетки, по показаниям проведены компьютерная томография органов грудной клетки, эзофагогастродуоденоскопия, рентгенконтрастное исследование пищевода, водно-сифонная проба. Комплекс лечебных мероприятий у детей с дисфагией включал соблюдение диеты, режимные мероприятия и медикаментозную терапию.
Материал и методы
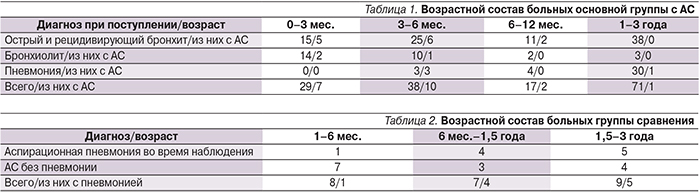
За 2013–2015 гг. в Центр здоровья детей были госпитализированы 162 ребенка в возрасте от 0 до 3 лет с респираторными заболеваниями (пневмония, острый бронхит, бронхиолит). Из этого числа у 27 детей был выявлен АС в отсутствие какой бы то ни было другой неврологической патологии, кроме дисфагии. Эти дети составили основную группу исследования. Возраст и диагнозы детей, госпитализиро-ванных с респираторными жалобами по возрасту и нозологии, представлены в табл. 1.
В группу сравнения были включены 24 ребенка с АС на фоне органического поражения центральной нервной системы из отделений психоневрологии и патологии детей раннего возраста.
Возраст и форма неврологических нарушений приведены в табл. 2.
Наиболее часто аспирация пищи встречалась у детей в возрасте до 6 месяцев (32%).
Аспирационный бронхит выявлен у 13 (14,6%) из 89 детей с бронхитом.
В первом полугодии жизни из 40 детей с бронхитом аспирация была у 11 (27,5%) детей. У детей старше 6 месяцев аспирация выявлена всего в 2 (4%) случаях из 49. Аспирация у детей с бронхиолитом имела место в первом полугодии жизни, частота АС достигала 12,5%. Из 7 детей в возрасте до 12 месяцев, госпитализированных с пневмонией, аспирационный генез выявлен у 3. Из 30 детей с пневмонией в возрасте от года до 3 лет аспирационная пневмония была диагностирована у 1 ребенка с дисфагией на фоне аномалии развития твердого неба. У детей из основной группы в возрасте до года все выявленные пневмонии имели аспирационный генез. Из 24 детей группы сравнения псевдобульбарный синдром был у 20 детей, 2 ребенка имели бульбарные нарушения. В течение госпитализации острая пневмония развилась у 10 детей. У 3 детей при обследовании были выявлены изменения, свидетельствующие о ранее перенесенной пневмонии. В отличие от основной группы пневмония была выявлена у детей в возрасте старше 6 месяцев. Развитие аспирационной пневмонии достоверно чаще наблюдалось в группе сравнения (14,8 и 41,6% соответственно, р=0,05%). Число повторно рожавших матерей (вторые роды и более) было достоверно выше в группе сравнения (29,6 и 58% соответственно, р=0,05%).
Указания на симптомы, которые позволили бы предположить наличие дисфагии, были у 9 из 11 детей с аспирационным бронхитом в возрасте до 6 месяцев. Поводом для госпитализации таких пациентов послужили длительно сохраняющиеся респираторные проявления. Это указывало на то, что у таких детей последний бронхит был не столько инфекционной природы, сколько аспирационной. У части детей наличие привычной аспирации пищи проявлялось тем, что они поступали в клинику в поздние сроки заболевания – после 3–5–8 дней отсутствия эффекта от лечения. Из 27 детей основной группы 12 поступили после стационарного лечения в другом медицинском учреждении, 8 детям назначался бронхолитик, 6 – будесонид. Еще 2 детей поступили с клиникой острого респираторного заболевания, в структуре которого развился бронхит.
У этих детей не было лихорадки, воспалительной реакции крови, наличие аспирации ухудшало респираторную функцию. У детей с бронхиолитом аспирации в анамнезе не было, она имела место лишь во время острого заболевания, что в отличие от детей с бронхитами позволяет считать инфекцию триггером аспирации. У детей с пневмонией в анамнезе также не было аспирации, они не имели длительного кашля, эпизодов бронхообструкции, признаков дисфагии. Аспирация пищи возникла на фоне острого респираторного заболевания. В группе сравнения АС имел место с первого полугодия жизни детей. В клинической картине преобладали бульбарные и псевдобульбарные нарушения, судорожный синдром, отставание в развитии, гипотрофия. Из 24 детей 17 после рождения потребовалась искусственная вентиляция легких.
Дети с аспирационным бронхитом поступали с жалобами на длительный, плохо поддающийся терапии кашель, эпизоды свистящего дыхания, наличие дистанционных хрипов, присутствовала одышка, обилие густой вязкой мокроты, наличие хрипов, усиливающихся после кормления. При этом отсутствовали лихорадка, изменения гематологических показателей. Наличие аспирации пищи у детей с бронхиолитом утяжеляло их клиническую картину, способствуя более длительному и стойкому сохранению дыхательной недостаточности, гиперпродукции густой вязкой мокроты. В отличие от детей с бронхитами эти дети начали поперхиваться и закашливаться при кормлении лишь во время острого эпизода заболевания; кроме того, имели место десатурация и изменения гематологических показателей. В случае аспирационной пневмонии клиническая картина заметно отличалась от таковой при бронхите или бронхиолите: присутствовали выраженные признаки тяжести, высокая лихорадка, асимметрия хрипов при аускультации легких. Уровень лейкоцитов периферической крови у 3 детей оставался нормальным. В группе сравнения из 24 детей в возрасте до 3 лет, госпитализированных в плановом порядке, у 10 пневмония аспирационного генеза возникла во время пребывания в стационаре. Длительность острого заболевания в контрольной группе была выше, чем в основной, в среднем на 3 дня. Сопоставляя особенности респираторных проявлений аспирации, мы не выявили достоверных различий ни в частоте бронхообструктивного синдрома (50 и 74% соответственно), ни в частоте ГЭР (50 и 74% соответственно). Эти данные показывают, что ни обструкция, ни ГЭР не были основной причиной респираторного синдрома.
На рентгенограмме грудной клетки у детей с аспирационным бронхитом и бронхиолитом отмечались косвенные признаки микроаспирации (неоднородность легочных полей в области верхушек легких, преимущественно справа). Аспирационная пневмония у детей основной группы проявлялась характерным появлением инфильтрата в верхней доле правого легкого. Из 10 детей группы сравнения с аспирационной пневмонией, развившейся в клинике, рентгенологическое исследование проведено 8 раз, компьютерная томография органов грудной клетки – 7 раз (6 детям проведено и то и другое). По результатам компьютерной томографии в 7 случаях выявлены изменения в верхней доле правого легкого, в 1 – в нижней доле левого легкого. У 3 детей, по данным КТ, выявлены изменения в верхней доле правого легкого, что позволяет думать о ранее перенесенных аспирационных пневмониях. Еще 2 ребенка имели некоторое усиление легочного рисунка, множество мелких очаговых теней – преимущественно в верхних долях легких. От остальных детей не получено рентгенологических признаков поражения легочной ткани, несмотря на наличие у них псевдобульбарных расстройств, ГЭР. У 2 детей на рентгенограмме и компьютерной томограмме были выявлены признаки пневмофиброза. У 10 детей с дисфагией на фоне псевдобульбарного синдрома выявлены инфильтративные изменения, характерные для острой пневмонии. У 1 ребенка выраженные бронхитические изменения, у 8 детей – норма, остальным 5 детям компьютерную томографию органов грудной клетки не проводили ввиду отсутствия показаний. Наличие изменений на рентгенограмме органов грудной клетки в виде «заплеванности», сгущения рисунка в верхушках легких достоверно чаще встречалась в группе сравнения (16,7 и 66,7% соответственно, р=0,01%).
Наличие инфильтративных изменений в верхней доле правого легкого по результатам рентгенограммы органов грудной клетки достоверно чаще встречалось в группе сравнения (11,1 и 41,7% соответственно; р=0,05%).
Комплекс лечебных мероприятий у детей с дисфагией включал изменения диеты (введение в рацион загустителя или антирефлюксной смеси, безмолочной рисовой каши – 15 мл после каждого кормления; подбор соски с подходящим размером отверстия; переход на кормление с ложки; увеличение кратности и уменьшение объема разового кормления; исключение кислых и сладких продуктов) и противоаспи-рационный режим (подбор позиции для кормления, в которой аспирация наименее выражена; приподнятое положение головного конца кровати до 30–45°; проведение последнего кормления за 2–3 часа до сна). Всем детям проведены дренажный массаж грудной клетки и санация верхних дыхательных путей электроаспиратором. Введение всех этих мер потребовало настойчивой работы с роди-телями.
Наряду с диетической коррекцией и противоаспирационными мероприятиями вводились прокинетикики (домперидон 0,5–1,5 мг/кг/сут перед едой) 10 детям. Как правило, всего вышеперечисленного было достаточно для уменьшения проявлений микроаспирации, лишь 3 детям с инструментально подтвержденным ГЭР потребовалось назначение ингибитора протонной помпы (эзомепразол по 5 мг/сут 1 раз на ночь) и антацида (алюминия фосфат 4 г перед кормлением до 6 раз в сутки). Детям с бронхообструктивным синдромом назначалась ингаляционная терапия бронхолитиком (ипратропия бромид+фенотерол 0,1 мл на кг массы тела), но в половине случаев выраженного эффекта в виде повышения оксигенации не наблюдалось. Антибактериальную терапию получили 16 детей с аспирационной пневмонией.
В ходе катамнестического наблюдения было установлено, что у детей без органических неврологических заболеваний (n=20) на фоне рекомендованного лечения респираторные проявления уменьшились и через 2–3 месяцев полностью сгладились. В то же время у 10 детей аспирация прослеживалась до 1,0–1,5 лет. Дети, у которых аспирация проявилась во время бронхиолита, восстанавливались быстрее, чем дети с бронхитом. В отличие от этого у детей группы сравнения сохранялись стойкие глотательные нарушения и респираторная симптоматика в том возрасте, когда дети без неврологической симптоматики уже выздоравливали. При соблюдении всех рекомендованных противоаспирационных мероприятий в основной группе все дети были выписаны с улучшением или полным выздоровлением, в контрольной группе происходило стихание острого процесса, однако сохранялись стойкие явления дисфагии, длительно сохранялся кашель, гиперпродукция слизи в верхних дыхательных путях. Кроме того, на фоне фебрильного заболевания происходило усиление судорожного синдрома, связанного с основным заболеванием, что утяжеляло состояние ребенка.
Отдельного внимания заслуживают 7 детей, не указанных в табл. 1, которые были госпитализированы без катарального синдрома. Причиной обращения за помощью со стороны 4 детей было наличие в анамнезе эпизода т.н. аффективно-респираторного пароксизма, который в последнее время принято именовать угрожающим жизни эпизодом. У них не было респираторных проявлений, дисфагия носила эпизодический характер и не было никаких изменений на рентгенограмме органов грудной клетки. У 3 детей имел место синдром Сандифера: у 1 ребенка – его развернутая форма; у 2 детей имел место неполный симптомокомплекс: акт глотания происходил с задержкой молока в полости рта на фоне резкого поворота головы в сторону и сопровождался слабовыраженным тоническим напряжением мышц шеи и конечностей, плачем. Аускультативная картина у этих детей была в норме, изредка выслушивались единичные влажные хрипы в верхних отделах легких, исчезающие после откашливания, что заставило думать о значительной компенсации дисфагии за счет поворота головы во время глотания. При помощи рентгенконтрастного исследования верхних отделов желудочно-кишечного тракта и эзофагогастродуоденоскопии был подтвержден ГЭР.
Обсуждение
Основной причиной аспирации у детей грудного возраста считается патология центральной нервной системы [16]. Однако наши данные показывают, что аспирация часто встречается у здоровых детей, обусловливая значительный процент госпитализации по поводу бронхиолита и затяжного кашля или рецидивирующего бронхита. Выявление привычной аспирации пищи у детей раннего возраста, особенно первого полугодия жизни, остается важной задачей клинициста, поскольку достаточно простыми мерами и мягким медикаментозным воздействием можно существенно уменьшить аспирацию и частоту респираторных заболеваний.
Причиной возникновения дисфагии у детей первых месяцев жизни чаще всего считаются патология центральной нервной системы и нейромышечная патология, парез мягкого неба, аномалии челюстно-лицевого скелета, стридор, сдавление пищевода аномальным сосудом, семейная дизаутономия Райли-Дея. Анатомические нарушения, такие как расщелина твердого и мягкого неба, трахеопищеводный свищ, дуоденальная обструкция или мальротация, а также макроглоссия и микрогнатия могут усиливать риск и предрасполагать к аспирации [1].
У значительного числа больных дисфагия является единственным симптомом. Аспирация зачастую протекает стерто и впервые выявляется при острых и особенно рецидивирующих респираторных синдромах, нередко является причиной аспирационной пневмонии [2, 20]. Наши данные показали, что у детей, госпитализированных с респираторной патологией в возрасте до 6 месяцев, АС встречался у каждого 3-го (32%) ребенка, более того, из всех 37 детей в возрасте до 3 лет аспирационная пневмония составила 10,8%.
У детей в возрасте до года, особенно первого полугодия жизни, поступивших с респираторными жалобами, аспирация выявлена у 17 (27,5%) из 67. Кроме того, наши данные позволяют считать, что у 14 из 67 детей именно аспирация, а не инфекция стала причиной рецидивирующих респираторных жалоб или пневмонии. И лишь у 3 детей аспирация возникла на фоне бронхиолита, ставшего, по-видимому, триггером. Хотя число клинических наблюдений невелико, мы не можем не отметить, что из всех 3 детей первых 6 месяцев, госпитализированных в наше отделение с пневмонией, во всех случаях ее причиной была аспирация.
У детей без неврологических нарушений применение простых мер давало хороший эффект с постепенным уменьшением дисфагии и особенно кашля и бронхообструктивных проявлений. Применение домперидона на этом фоне не оказало значительного влияния на детей с ГЭР. Тот же комплекс оказался эффективным в отношении детей с синдромом Сандифера. Он позволил практически ликвидировать характерные для него признаки в течение месяца. Тот же комплекс у детей
с псевдобульбарным синдромом дал далеко не полный эффект. В отличие от детей основной группы у детей группы сравнения пневмония, развившаяся в отделении и имевшая место ранее, наблюдалась существенно чаще (10 из 24 детей) и не только в первом полугодии, но и на 1–3-м году жизни. Это можно объяснить наличием у них псевдобульбарного и бульбарного синдромов и прогрессированием неврологической симптоматики.
В ходе нашего исследования ГЭР был диагностирован у 4 детей основной группы и у двух детей группы сравнения, что составило 14,8 и 8,3% соответственно и не превышало частоту ГЭР у здоровых детей. Гастроэзофагеальная рефлюксная болезнь у детей с неврологической патологией нередко требует хирургического лечения, поскольку именно у этих пациентов значительно чаще возникают осложнения со стороны дыхательной системы, в т.ч. с летальным исходом [21]. Двум из 24 детей контрольной группы в связи с неуклонным прогрессированием неврологической симптоматики, наличием псевдобульбарных расстройств, эпизодов апноэ и АС, белково-энергетической недостаточности была установлена пункционная низкопрофильная гастростома. Детей с тяжелыми необратимыми поражениями центральной нервной системы при невозможности хирургического лечения целесообразно кормить через зонд или гастростому. H. Williams, P. Phelan, однако, не рекомендуют этого – даже при выраженной аспирации и согласии родителей [22].
Заключение
Приведенные данные показывают, что аспирация пищи служит достаточно частой причиной респираторного синдрома, особенно у детей первого полугодия жизни. Наличие аспирации пищи связано не с ГЭР, а с дисфагией. Частота срыгиваний и инструментально установленный ГЭР у детей с аспирацией в целом не отличаются от частоты ГЭР у здоровых детей. Респираторный синдром у детей с привычной аспирацией пищи характеризуется повторными эпизодами кашля, обструкции с тенденцией к затяжному течению за счет продолжающейся аспирации и требует строгого соблюдения комплекса мер, направленных на ее уменьшение.