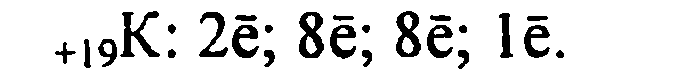Неметаллические свойства азота слабее чем неметаллические свойства фосфора
Химия
А Вы уже инвестируете?
Слышали про акцию в подарок?
Зарегистрируйся по этой ссылке
и получи акцию до 100.000 руб
План урока:
Азот и фосфор
Азот находится под номером 7 в периодической системе, соответственно и заряд ядра его равен +7. Атомный вес равен 14,007 а.е.м. Неметалл, второй период, V группа A подгруппа.
Азот — простое вещество. В природе азот – двухатомная молекула N2 (представлена ниже). Отличительная черта молекулы этого элемента — это связь ее атомов через очень прочную ковалентную связь.
Строение атома азота Источник
Строение атома фосфора Источник
На данный момент известно, что данное вещество способно на аллотропию 11 раз, именно столько модификаций есть в природе данного элемента. Наиболее распространены три (или можно объединить их в три группы): черный, белый и красный. О них будет речь ниже.
Аллотропия фосфора
Наибольшее распространение получил фосфор белый, из-за примесей иногда бывает желтого цвета. Молекулярная решетка, составлена четырьмя атомами фосфора.
Вещество быстро вступает в реакции, пластилинообразное на ощупь, неприятное на запах, с нотками чеснока. Цвета бледновато желтого. Растворим в сероуглероде и бензоле, но не в воде. В реакции с паром H2O получаем смесь из газов. Токсично, возгорается в процессе трения. Светится в темноте. Плавится при 44 градусах. Особые условия хранения, ввиду активности вещества хранят под слоем воды.
Красный фосфор — разновидность фосфора, цветовая гамма которых расположилась от оранжевого до фиолетового спектра. Плотность так же различна, как и окрас. За образование красного фосфора ответственен белый фосфор, но нагретый порядком до 320 °С без кислорода. Дальнейшее нагревание до 560 °С кристаллизует и увеличивает температуру, при которой красный фосфор будет плавиться, попутно уменьшая реакционную способность. Исходя из выше написанного мы можем считать, что эта модификация фосфора менее активна белого фосфора. Не растворимо в воде и в сероуглероде. Безвредно, но и в темноте не светится.
Следующая модификация фосфора (черная) добывают из белого, нагревая последний до 230 °С и повышая давление. Наиболее стабильная форма. Имеет три разновидности: ромбическую, кубическую и гексагональную. Отличие разновидностей в строении молекулярной решетки.
Эта разновидность фосфора по внешним особенностям больше похожа на металл, об этом говорит его блеск и наличие свойств электро- и теплопроводности. Почти инертен, не вступает в реакцию даже с растворителями органического рода, твердый на ощупь.
Основные соединения азота и фосфора
Основные соединения азота
Получение аммиака:
3H2 + N2 → 2NH3 + Q, необходимы условия для стабилизации реакции и для наибольшего выхода: давление от 15 до 100 Мпа и катализаторы.
Аммиак. Водный раствор (нашатырный спирт)
Получение аммиака в лаборатории возможно путем взаимодействия гашеной извести и твердого хлорида аммония (NH4Cl). При этом необходимо смесь нагревать.
Свойства аммиака
Оксиды азота
Азот выделяется среди других элементов большим количеством оксидов. Его оксиды термодинамически неустойчивы к распаду на простые вещества. Но при 700 °С реакция разложения оксидов кинетически заторможена. О них будет идти речь ниже.
Азотистая кислота. Формула HNO2
Нитрат аммония (аммонийная селитра) NH4NO3. Продукт взаимодействия азотной кислоты с NH4OH (гидрат аммиака). Первооткрывателем вещества является Иоганн Глаубер. Открыто вещество в 1659 году. Применяется как компонент взрывчатых веществ и удобрение.
Минеральные удобрения — это группа неорганических соединений, питающие растения элементами в виде минеральных солей различного рода. Активно применяется в Агро промышленности.
Взаимодействие азотной кислоты с металлами и неметаллами
Взаимодействие с металлами
При этом есть одна закономерность в реакциях азотной кислоты и металлов: чем менее концентрирована азотная кислота и более активен метал, тем больше происходит восстановление азота:
Реакции с металлами протекают по окислительно-восстановительному механизму, коэффициенты в уравнениях реакций могут быть определены методом электронного баланса.
Пример
Взаимодействие концентрированной азотной кислоты с медью.
Обобщенные особенности взаимодействия азотной кислоты с металлами можно выделить следующие:
Краткая схема протекания реакции азотной кислоты с металлами: Металл + НNO3 ↔ вода + нитрат + газ
Основные соединения фосфора
Фосфор достаточно активный элемент и образует большое количество оксидов, среди них можно выделить два. Наиболее важные: оксид фосфора (III) P2O3 и оксид фосфора (V) P2O5.
Первый оксид называют иначе фосфористым ангидридом (P2O3). Получают при медленном сжигании фосфора в бескислородной среде.
В нормальном состоянии представляет собой белую массу, состоящую из хлопьев или кристаллов. Токсичен. Очень летучий. На свету сначала желтеет, потом краснеет. Хорошая растворимость в органических растворителях (в бензоле и сероуглероде). По своей природе оксид кислотный.
Подвергается окислению кислородом, образуя наш следующий оксид (Р2О5):
Оксид фосфора (V) – фосфорный ангидрид. При нормальных условиях представлен в виде белого влагопоглощающего порошка. Из-за влагопоглощающих свойств, хранение осуществляется в плотно закрытых сосудах. Наиболее часто применяют свойство влагопоглощения при осушении газов и жидкостей. Получают, как указано в предыдущей реакции, окислением оксида выше или же сжиганием фосфора в избытке кислорода:
Оксид по своей природе кислотный, и соответственно осуществляет взаимодействие с водой, оксидами основной природы и щелочами:
Р2О5 + Н2О →2HPO3 при температуре 0°С образуется метафосфорная кислота
Р2О5 + 6NaOH →ЗН2О + 2Na3PO4(ортофосфат натрия, средняя соль)
Р2О5 + 4NaOH →Н2О + 2Na2HPO4(гидрофосфа́т на́трия, кислая соль)
Р2О5 + 2NaOH →Н2О + 2NaH2PO4(дигидрофосфат натрия, кислая соль)
Фосфорные кислоты
Получение фосфорной кислоты:
Химические свойства азота и фосфора
Химические свойства азота
Тройная связь влияет на активность азота. Соединения азота разлагаются легко, при нагревании образуются свободный азот.
Химические свойства фосфор
Реакционная способность наивысшая у белого фосфора и наименьшая у черного, почти инертен. Ясно иллюстрируется градация активности, зависящая от модификации.
При этом фосфор имеет большую реакционную способность. Это распространяется как на простые, так и на сложные вещества.
Соединения фосфора с кислородом прочнее таковых соединений с азотом. Это происходит из-за того, что неметаллические свойства фосфора слабее, чем неметаллические свойства азота.
Неметаллические свойства азота слабее чем неметаллические свойства фосфора
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
Металлические свойства простых веществ в периодической системе усиливаются в группах — сверху вниз, в периодах — справа налево. Поэтому верен ряд № 3.
Правильный ответ указан под номером: 3.
правильным ответом является вариант 1, а не 3, так как это соответствует пояснению
Ряд номер один перечислен в порядке снизу вверх, поэтому неверен.
В условии написано металлические свойства, а углерод, кремний неметаллы же. Правильный ответ под номером 1
Диана, вот именно, что СВОЙСТВА.
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) кислород → фтор → неон
2) кремний → сера → хлор
3) селен → сера → кислород
4) алюминий → магний → натрий
Металлические свойства простых веществ усиливаются по ряду элементов периодической системы сверху вниз и справа налево. Поэтому верен ряд №4.
Правильный ответ указан под номером: 4.
Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства
Неметаллические свойства простых веществ в периодической системе усиливаются в группах — снизу вверх, а в периодах — слева направо.
Поэтому неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства кремния, и слабее остальных представленных элементов.
Правильный ответ указан под номером 4.
2 варианта ответа правильны и 4 и 3
Никита, необходимо найти элемент, у которого неметаллические свойства слабее, чем у фосфора.
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1)
2)
3)
4)
Атомный радиус увеличивается по периоду справа налево, по группе сверху вниз. Поэтому в ряду №2 химические элементы расположены в порядке возрастания их атомного радиуса.
Правильный ответ указан под номером: 2.
правильный ответ номер 1 по таблице Менделеева с начало идёт C, потом N, затем O.
Атомный радиус увеличивается по периоду справа налево.
От кислотных к основным меняются свойства оксидов в ряду
1)
2)
3)
4)
Основные свойства оксидов усиливаются по периоду справа налево.
В первом ряду свойства оксидов меняются от основных к кислотным, во втором — от основных к амфотерным, в четвёртом — представлены только кислотные оксиды, а в третьем — от кислотного через амфотерный к основному.
Помигите кто может или мне завтра хана.
1)Число электронов во внешнем электронном слое атома, ядро которого
содержит 8 протонов, равно
1) 8
2) 2
3) 6
4) 4
2)Неметаллические свойства фосфора выражены сильнее, чем
неметаллические свойства
1) кислорода
2) азота
3) алюминия
4) хлора
3)Ковалентная полярная связь образуется между атомами
1) натрия и брома
2) серы и кислорода
3) водорода
4) калия и хлора
4)Атомы азота и углерода имеют одинаковую степень окисления в
соединениях
1) NH3 и CO
2) NO2 и ССl4
3) N2O3 и СО2
4) Na3N и CH4
5)Сложным является каждое из двух веществ:
1) аммиак и серная кислота
2) медь и гидроксид натрия
3) сульфат бария и водород
4) вода и алмаз
6)К химическим явлениям относится процесс
1) образования инея
2) плавления парафиновой свечи
3) горения древесины
4) распространения запаха духов
7)Какая из записей соответствует уравнению окислительно-восстановительной
реакции?
1) CO2 + Ca(OH)2 = CaCO3 + H2O
2) 2HBr + Na2O = 2NаBr + H2O
3) H2SО4 + BаO = BаSО4 + H2O
4) 2NO2 + H2O = HNO3 + HNO2
8)Вещество, при диссоциации которого образуется сульфид-ион, имеет
формулу
1) Na2S
2) S
3) K2SO3
4) CuSO4
9)3 моль катионов образуется при полной диссоциации 1 моль
1) фосфата натрия
2) нитрата алюминия
3) хлорида железа (III)
4) гидроксида кальция
10)Выделение газа происходит при нагревании раствора, содержащего ионы
1) NH4
+ и SO4
2–
2) H+ и SiO3
2–
3) H+ и OH–
4) NH4
+ и OH–
11)И кислород, и водород вступают в реакцию с
1) FeO
2) CaO
3) NH3
4) H2S
12)Оксид магния реагирует с
1) KCl
2) NaOH
3) SO3
4) BaSO4
13)При взаимодействии гидроксида железа (II) с раствором серной кислоты
образуются
1) FeSO4 и H2O
2) Fe2(SO4)3 и H2O
3) FeSO4 и H2
4) Fe2(SO4)3 и H2
14)В реакцию с соляной кислотой вступает
1) хлорид натрия
2) карбонат натрия
3) нитрат натрия
4) сульфат натрия
15)С раствором сульфата меди (II) реагирует
1) Fe(OH)3
2) Zn
3) H2SiO3
4) MgO
17)Верны ли следующие суждения об использовании лабораторного
оборудования и правилах хранения препаратов бытовой химии?
А. Для отбора определенного объема жидкости используют мерный
цилиндр.
Б. Средства бытовой химии следует хранить отдельно от продуктов
питания.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
У какого элемента ярче выражены неметаллические свойства у азота или фосфора
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Описание презентации по отдельным слайдам:
1 слайд
Описание слайда:
2 слайд
Описание слайда:
Удивить готов он нас – Он и уголь, и алмаз, Он в карандашах сидит, Потому что он — графит. Грамотный народ поймет То, что это … В чем горят дрова и газ, Фосфор, водород, алмаз? Дышит чем любой из нас Каждый миг и каждый час? Без чего мертва природа? Правильно, без … В воздухе он главный газ, Окружает всюду нас. Угасает жизнь растений Без него, без удобрений. В наших клеточках живет Важный элемент … КИСЛОРОДА АЗОТ УГЛЕРОД
3 слайд
Описание слайда:
4 слайд
Описание слайда:
5 слайд
Описание слайда:
Кроме того, к неметаллам относят также водород и гелий. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов: O 1ѕ²2ѕ²2p⁴ Cl 1ѕ²2s²2p⁶3s²3p⁵ Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
6 слайд
7 слайд
Описание слайда:
ЗАДАНИЕ: Напишите электронные формулы – серы, фтора, мышьяка, брома S 1s²2s²2p⁶3s²3p⁴ F 1s²2s²2p⁵ As 1s²2s²2p⁶3s²3p⁶4s²4p³ Br 1s²2s²2p⁶3s²3p⁶4s²4p⁵ У какого из элементов ярче выражены неметаллические свойства и почему: а) As – N б) Cl – S а) N – меньше радиус атома (больше значение электроотрицательности) б) Cl – меньше радиус атома, больше валентных электронов ( больше значение ЭО)
8 слайд
Описание слайда:
НАХОЖДЕНИЕ НЕМЕТАЛЛОВ В ПРИРОДЕ В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром. Распространёнными являются кислород, кремний, водород; редкими — мышьяк, селен, иод.
9 слайд
10 слайд
Описание слайда:
Чаще неметаллы находятся в химически связанном виде: вода, минералы, горные породы, различные силикаты, фосфаты, сульфиды. силикат натрия сульфид свинца
11 слайд
Описание слайда:
12 слайд
Описание слайда:
а т м о с ф е р а к л е т к а
13 слайд
Описание слайда:
14 слайд
Описание слайда:
15 слайд
Описание слайда:
16 слайд
Описание слайда:
С Е Р А КРАСНЫЙ ФОСФОР БЕЛЫЙ ФОСФОР
17 слайд
Описание слайда:
18 слайд
Описание слайда:
У некоторых неметаллов наблюдается проявление аллотропии: – для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), – для твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, фуллерены, стеклоуглерод ФИЗИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ АЛМАЗ ГРАФИТ
19 слайд
Описание слайда:
20 слайд
Описание слайда:
21 слайд
Описание слайда:
ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ Окислительные свойства простых веществ: Реагируют с металлами 2K + S⁰ = K₂S⁻² 3Ca + N₂⁰ = Ca₃N₂⁻³ 2Fe + 3 Cl₂⁰ = 2 FeCl⁻₃ Реагируют с водородом H₂ + S⁰ = H₂S⁻² 3N₂⁰ + H₂ = 2N⁻³H₃ Реагируют с неметаллами с более низким значением электроотрицательности 2P⁰ + 5S⁰ = P₂⁺⁵S₅⁻² S⁰ + 3 F₂⁰ = S⁺⁶F₆⁻ Реагируют с некоторыми сложными веществами C⁻⁴H⁺₄ + 2 O⁰₂ = C⁺⁴O₂⁻² + 2 H₂⁺O⁻² 2 KI⁻ + Cl₂⁰ = 2 KCl⁻ + I₂⁰
22 слайд
Описание слайда:
23 слайд
Описание слайда:
Восстановительные свойства неметаллов ( простых веществ): Со фтором все восстановители 2) С кислородом S⁰ + O₂ = S⁺⁴O₂ Si⁰ + O₂ = Si⁺⁴O₂ 4P⁰ + 5O₂ = 2P₂⁺⁵O₅ 3) Со сложными веществами-окислителями Например – H₂, C 3C⁰ + 2Fe₂O₃ = 3C⁺⁴O₂ + 4Fe H₂⁰ + CuO = H₂⁺O + Cu
24 слайд
Описание слайда:
ЗАДАНИЕ Составьте уравнения реакций и определите восстановитель: Si + F₂→ S + H₂SO₄ → SO₂ + … H₂ + WO₃ → Br₂ + H₂S → S + … Li + N₂ → C + HNO₃ → NO₂ + … + … ОТВЕТ: Si + 2F₂ = SiF₄ 3H₂ + WO₃ = 3H₂O + W 6Li + N₂ = 2Li₃N S + 2H₂SO₄ = 3SO₂ + 2H₂O Br₂ + H₂S = S + 2HBr C + 4HNO₃ = CO₂ + 2H₂O+ 4NO₂
25 слайд
Описание слайда:
ПОЛУЧЕНИЕ НЕМЕТАЛЛОВ в промышленности
26 слайд
Описание слайда:
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот: В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 %
27 слайд
Описание слайда:
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С: Образующиеся пары белого фосфора конденсируются 2Ca₃(PO₄)₂↓+10C+6SiO₂↓=P₄+10CO↑+6CaSiO₃↓ в приёмнике под водой.
28 слайд
Описание слайда:
Хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли: 2NaCl + 2H2О ±2е- → H2↑ + Cl2↑ + 2NaOH
29 слайд
Описание слайда:
Р Е Б У С Ы Й О Д К Р Е М Н И Й
30 слайд
Описание слайда:
А З О Т У Г Л Е Р О Д
31 слайд
Описание слайда:
1. Неметаллы, расположенные в порядке усиления их неметалличности, – это 1) азот, углерод, бор 3) фтор, кислород, хлор 2) сера, хлор, фтор 4) бор, кремний, водород 2. Неметаллические свойства элементов в ряду углерод- азот- кислород-фтор: 1) не изменяются 2) усиливаются 3) ослабевают 4) изменяются периодически Т Е С Т ОТВЕТ: 1 – 2 2 – 2 3 – 4 4 – 3 3.Завершенный внешний энергетический имеет частица: 1) P⁺³ 2) S⁺⁴ 3) Cl⁺⁵ 4) C⁻⁴ 4. Частице Si⁻⁴ соответствует электронная конфигурация: 1) 1s²2s²2p⁶3s² 2) 1s²2s²2p⁶3s²3p⁴ 3) 1s²2s²2p⁶3s²3p⁶4s²
32 слайд
Описание слайда:
33 слайд
Описание слайда:
9. Схеме превращения P⁻³→ P⁺⁵ соответствует уравнение: 1) 4P + 5O₂ = 2P₂O₅ 2) P₂O₅ + 3H₂O = 2H₃PO₄ 3)2PH₃ + 4O₂ = P₂O₅ + 3H₂O 4) P₂O₅ + 6NaOH = 2Na₃PO₄ + 3H₂O ОТВЕТ: 9 – 3 10. Простое вещество сера взаимодействует с каждым из веществ ряда: 1) HCl, Na, O₂ 2) Mg, O₂, H₂ 3) K, Zn, Na₂SO₄ 4) Al, H₂O, O₂ ОТВЕТ: 10 – 2 11. Расставьте коэффициенты в схеме реакции: P + H₂SO₄ → H₃PO₄+ SO₂ + H₂O ОТВЕТ: 2P⁰ + 5H₂S⁺⁶O₄ → 2H₃P⁺⁵O₄+ 5S⁺⁴O₂ + 2H₂O
Выберите книгу со скидкой:
БОЛЕЕ 58 000 КНИГ И ШИРОКИЙ ВЫБОР КАНЦТОВАРОВ! ИНФОЛАВКА
Инфолавка – книжный магазин для педагогов и родителей от проекта «Инфоурок»
Курс повышения квалификации
Курс профессиональной переподготовки
Курс профессиональной переподготовки
Учитель биологии и химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Учебник:
«Химия. Базовый уровень», Габриелян О.С.