Нефропатия что это у мужчин
Нефропатия
Скидки для друзей из социальных сетей!
Для жителей районов Савеловский, Беговой, Аэропорт, Хорошевский
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский» предоставляется скидка 5% на ВСЕ мед.
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
Нефропатией в медицине обозначается поражение почек, лишающее их основной фильтрационной функции в значительной, а при отсутствии своевременного лечения, и в полной степени. Нефропатия – одна из основных причин почечной недостаточности.
Причины и симптомы нефропатии
Нефропатию может вызывать ряд заболеваний, прежде всего, сахарный диабет, эндокринные расстройства, токсические отравления, онкологические заболевания и т.д.
Возникнув на фоне какого-либо заболевания или вследствие того или иного негативного воздействия на здоровье человека, нефропатия может развиваться довольно медленно, первое время не проявляя себя особыми симптомами.
Затем появляются слабость, одышка и утомляемость, головные боли, боли в поясничной области. Человек начинает чаще испытывать жажду.
При дальнейшем развитии нефропатии начинают появляться отёки, возникают проблемы с давлением. Возникает угроза появления хронической почечной недостаточности.
Кроме того, на фоне нефропатии возрастает риск воспалительных заболеваний почек – пиелонефритов.
Консультация нефролога в МедикСити
Консультация нефролога в МедикСити
Консультация нефролога в МедикСити
Диагностика и лечение нефропатии
Чтобы избежать негативных последствий развития нефропатии, необходимо своевременно обращаться к врачу. В тех случаях, когда нефропатия возникает на фоне диабетических или онкологических заболеваний, её появление могут выявить при регулярных обследованиях на основании анализов крови и мочи. Признаками нефропатии являются протеинурия (белок в моче), увеличение плотности мочи и др.
Что же касается тех, кто подвергается риску развития нефропатии вследствие токсических отравлений, радиационного облучения и т.д., то им необходимо помнить о риске возникновения подобных проблем и своевременно обследоваться на предмет выявления возможных негативных последствий.
Беременные женщины также должны следить за своим состоянием – нефропатия может развиться вследствие сильного токсикоза.
Лечение нефропатии осуществляется, как правило, медикаментозным путем в условиях стационара.
Основной задачей при этом является купирование развития почечной недостаточности.
При своевременной медицинской помощи нефропатия полностью излечима, и функции почек могут быть восстановлены.
Важно учитывать, что наиболее эффективным противодействием развитию нефропатии является устранение вызвавших её причин, либо их должная профилактика.
Всё это требует внимания высокопрофессиональных опытных специалистов.
В клинике «МедикСити» к вашим услугам опытные врачи-терапевты, врачи-нефрологи, врачи-иммунологи и другие специалисты, в распоряжении которых первоклассная, оснащённая самым современным оборудованием лечебно-диагностическая база, уникальные методики диагностики и лечения заболеваний урологических, нефрологических и других профилей.
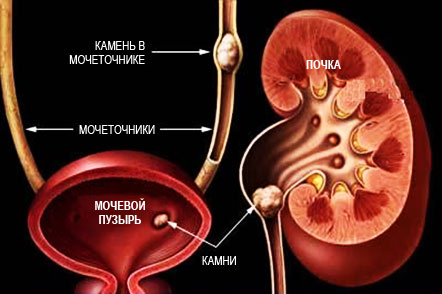
Нарушения минерального обмена в почках (дисметаболические нефропатии)
Содержание
В зависимости от причины развития выделяют первичные и вторичные НМО.
Первичные нарушения представляют собой наследственно обусловленные формы заболеваний, характеризующихся прогрессирующим течением, ранним развитием мочекаменной болезни (МКБ) и хронической почечной недостаточности (ХПН). Первичные дисметаболические нефропатии встречаются редко и начало клинических проявлений развивается уже в детском возрасте.
Вторичные дисметаболические нефропатии могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), применением ряда лекарственных средств и др.
Оскалатно-кальциевая нефропатия
Оксалатно-кальциевая нефропатия наиболее часто встречается в детском возрасте. Ее возникновение может быть связано с нарушением обмена кальция или оксалатов (солей щавелевой кислоты).
Причины образования оксалатов:
Оксалатная нефропатия представляет собой многофакторный патологический процесс. Наследственная предрасположенность к развитию оксалатной нефропатии встречается в 70–75%. Помимо генетических, большую роль играют такие внешние факторы, как: питание, стресс, экологические проблемы и др.
Первые проявления болезни могут развиться в любом возрасте, даже в период новорожденности. Чаще всего они выявляются в 5–7 лет в виде обнаружения кристаллов оксалатов, небольшим содержанием белка, лейкоцитов и эритроцитов в общем анализе мочи. Характерно повышение удельной плотности мочи. Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Фосфатная нефропатия
Фосфатная нефропатия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина фосфатурии – хроническая инфекция мочевой системы. Часто фосфатно-кальциевая нефропатия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени.
Уратная нефропатия (нарушения обмена мочевой кислоты)
Эта группа обменных нарушений наиболее часто встречается у взрослых. Первичные уратные нефропатииобусловлены наследственными нарушениями обмена мочевой кислоты. Вторичные возникают как осложнениядругих заболеваний (болезней крови и др.), являются следствием применения некоторых препаратов (тиазидовых диуретиков, цитостатиков, салицилатов, циклоспорина А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например). Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное скрытое течение процесса.
Цистиновая нефропатия
Цистин является продуктом обмена аминокислоты метионина. Можно выделить две основные причины повышения концентрации цистина в моче:
Накопление цистина в клетках происходит в результате генетического дефекта фермента цистинредуктазы. Это нарушение обмена носит системный характер и называется цистинозом. Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах. Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
По мере прогрессирования заболевания определяются признаки мочекаменной болезни, а при присоединении инфекции – воспаление почек.
Симптомы НМО
НМО почек, как правило, клинически течет бессимптомно до формирования мочекаменной болезни или пиелонефрита, но в ряде случаев могут проявляться следующими симптомами:
Диагностика НМО
Необходимое комплексное обследование включает лабораторные и инструментальные методы.
Лабораторная диагностика
Инструментальная диагностика
УЗИ органов брюшной полости. Изменения, выявляемые при УЗИ почек, как правило, мало специфичны. Возможно выявление в почке микролитов или «песка» (включений). УЗИ почек, как правило, является неспецифичным методом диагностики, однако в ряде случаев позволяет отследить формирование мелких камней и, таким образом, зафиксировать время возникновения мочекаменной болезни.
Лечение
Рекомендации по питанию являются основой терапии как в детском, так и во взрослом состоянии.
| Вид нефропатии | Запрещенные продукты |
| Оксалатная нефропатия | Мясные блюда, щавель, шпинат, клюква, свекла, морковь, какао, шоколад |
| Уратная нефропатия | Печень, почки, мясные бульоны, горох, фасоль, орехи, какао, алкогольные напитки |
| Фосфатная нефропатия | Сыр, печень, икра, курица, бобовые, шоколад |
| Цистиновая нефропатия | Творог, рыба, яйца, мясо |
Лечение оксалатной нефропатии
Лекарственная терапия включает мембранотропные препараты и антиоксиданты. Лечение должно быть длительным. Применяются витамины группы В, А, Е. Назначаются специальные препараты при кристаллурии. Помимо этого, назначается окись магния, особенно при повышенном содержании оксалатов.
Лечение уратной нефропатии
Для поддержания оптимальной кислотности мочи можно использовать цитратные смеси. При уратной нефропатии важно уменьшить концентрацию мочевой кислоты. Для этого используются средства, снижающие синтез мочевой кислоты.
Лечение фосфатной нефропатии
Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.).
Лечение при фосфатной нефропатии должно быть направлено на подкисление мочи (минеральные воды – нарзан, арзни, дзау-суар и др.; препараты – цистенал, аскорбиновая кислота, метионин).
При любой степени тяжести заболевания необходимо незамедлительно обратиться к врачу нефрологу или урологу за помощью, так как длительно текущие, в целом обратимые, нарушения обмена при отсутствии лечения могут привести к развитию мочекаменной болезни с последующим оперативным вмешательством и хронической почечной недостаточности. Самолечение не допустимо!
Все виды лекарственной терапии должен назначать и обязательно контролировать врач нефролог или уролог, так как:
На первом этапе лечения составляется план лечения. Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
Прием большого количества жидкости является универсальным способом лечения любой дисметаболической нефропатии, так как способствует уменьшению концентрации растворимых веществ в моче.
Одной из целей лечения является увеличение ночного объема мочеиспускания, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде.
Диета позволяет в значительной степени снизить солевую нагрузку на почки.
Специфическая терапия должна быть направлена на предупреждение конкретного кристаллообразования, выведение солей, нормализацию обменных процессов.
На втором этапе терапии производится оценка эффективности диеты, проводятся контрольные УЗ-исследования и анализы.
Третий этап лечения осуществляется после достижения стойкой ремиссии. Он представляет собой схему постепенного снижения доз назначенных препаратов до поддерживающих или полной их отмены с сохранением диетических рекомендаций.
Даже после достижения долгожданной ремиссии пациенту рекомендуется быть внимательным к себе и регулярно наблюдаться у врача нефролога или уролога, так как высок риск рецидива заболеваний.
Практически всем пациентам необходимо принимать рекомендованные врачом средства противорецидивной терапии или придерживаться ранее разработанной диеты для предотвращения формирования или прогрессирования МКБ, воспаления почек.
Прогноз
Прогноз при дисметаболической нефропатии в целом благоприятен. В большинстве случаев при соответствующем режиме, диете и лекарственной терапии удается добиться стойкой нормализации соответствующих показателей в моче. В отсутствие лечения или при его неэффективности наиболее естественным исходом дисметаболической нефропатии является мочекаменная болезнь и воспаление почек.
Самым частым осложнением дисметаболической нефропатии является развитие инфекции мочевой системы, в первую очередь пиелонефрита.
Если вы обнаружили у себя какие-либо из перечисленных выше симптомов (нарушение мочеотделения, изменения свойств мочи, боли), необходимо в ближайшее время обратиться к врачу за помощью.
Помните, что очень важно начать лечение на ранних стадиях болезни, так как НМО в почках является преимущественно обратимым состоянием, а в случае отсутвтия лечения итогом является развитие мочекаменной болезни, пиелонефрита.
Рекомендации
Для профилактики развития заболевания, а так же рецидива, необходимо придерживаться правильного, сбалансированного и регулярного питания – избегать острой пищи, маринадов и пр. В период обострения пациентам рекомендуется щадящая диета, соответствующая требованиям биохимического вида нефропатии (оксалатная, уратная и пр.).
С целью профилактики рецидивов всем пациентам рекомендуется один раз в квартал консультация врача нефролога или уролога для необходимой коррекции медикаментозной терапии и пищевых рекомендаций.
Пациенты, длительно страдающие НМО в почках, относятся к группе повышенного риска по МКБ. Поэтому в период ремиссии им необходимо ежегодно проходить по назначению врача контрольные обследования (общий анализ мочи, биохимия мочи, УЗИ почек, мочеточников, мочевого пузыря) мочевыводящей системы.
Часто задаваемые вопросы
Излечимы ли НМО?
НМО часто обусловлено наследственными нарушениями обмена, что требует постоянного соблюдения как минимум диетических рекомендаций.
Из-за чего возникает заболевание?
НМО может быть связано с наследственной предрасположенностью, а также с заболеваниями внутренних органов (желудочно-кишечные проблемы, заболевания крови и пр.), применением определенных групп лекарственных препаратов (мочегонные средства, цитостатики и пр.).
Является ли заболевание противопоказанием к беременности?
Само НМО в почках требует наблюдения весь период беременности с соблюдением диетических рекомендаций.
При развитии МКБ, пиелонефрита и их осложнений в виде ХПН, возможность беременности и ее сохранения зависит от обострения процесса и стадии осложнений и решается в каждом конкретном случае.
Может ли заболевание почек проявляться снижением потенции?
Непосредственно НМО конечно не влияет на потенцию, но в случае развития осложнений МКБ, воспаления почек или развития ХПН снижение потенции может появиться как реакция на хроническое заболевание.
Увеличивается ли риск заболеть, если близкий родственник страдает данным заболеванием?
Да, существует группа первичных обменных нефропатий (НМО в почках), имеющая наследственную предрасположенность.
Почечная недостаточность: симптомы, стадии, лечение
Почечная недостаточность – острое или хроническое заболевание, при котором нарушаются фильтрационная, выделительная и другие функции почек с развитием многочисленных сбоев в работе всего организма. При этом происходит отравление собственными токсичными продуктами обмена веществ, попавшими в кровь – уремия. Патология, особенно при стремительном развитии, может угрожать жизни больного и требует скорейшего лечения.
Распространенность хронической болезни почек во всем мире в среднем составляет 13,4%. В России почечная недостаточность встречается у 36% лиц старше 60 лет и у 16% граждан трудоспособного возраста.
Причины
Хроническая форма заболевания чаще всего развивается как осложнение других патологий. Ранее основной причиной почечной недостаточности считался гломерулонефрит. В настоящее же время ведущее место занимают гипертоническая болезнь и сахарный диабет, приводящие к поражению мелких сосудов, питающих почки, и стойкому нарушению кровообращения в них.
Острая почечная недостаточность (ОПН) более чем в половине случаев связана с травмой или перенесенными операциями на органах малого таза. Развивается она также при неправильном приеме лекарственных препаратов, нарушении работы сердца, кровотечениях и шоке, генерализованной аллергической реакции, обезвоживании, циррозе, отравлении, аутоиммунных и инфекционных болезнях, онкологии, переливании несовместимой крови.
Симптомы почечной недостаточности
Почки не только очищают кровь от токсинов и выводят их из организма, но также регулируют водно-солевой баланс, контролируют уровень артериального давления, тонус сосудов, концентрацию гемоглобина, помогают в сохранении здоровья опорно-двигательного аппарата и сердца. Учитывая такое многообразие функций органа, почечная недостаточность проявляется многочисленными симптомами, выраженность которых зависит от стадии и формы заболевания.
При остром повреждении почек на начальной стадии имеются лишь проявления основного заболевания. Далее следует самая тяжелая, олигурическая стадия, продолжительностью до 3-х недель, со снижением суточного объема мочи менее 500 мл. Первым признаком болезни становится резкое уменьшение или прекращение мочеиспускания.
Состояние часто обратимо (если обратимо основное заболевание или состояние, приведшее к ОПН) и при правильном лечении переходит в полиурическую стадию почечной недостаточности с восстановлением объема мочи. При этом самочувствие пациента нормализуется, но может развиваться обезвоживание организма и присоединиться инфекция. Стадия полного восстановления продолжается от шести месяцев до года. При выраженных нарушениях состояние переходит в хроническую форму.
Хроническая почечная недостаточность (ХПН) развивается медленно, в течение нескольких месяцев и даже лет, и приводит к стойким изменениям в органе. На начальном этапе специфических симптомов обычно не бывает, но иногда человек может заметить снижение объема выделяемой мочи. Либо единственным проявлением патологии может быть никтурия – частое ночное мочеиспускание.
Осложнения
Болезнь осложняется появлением артериальной гипертензии, анемии, перикардита, аритмии и сердечной недостаточности, остеопороза, подагры, энцефалопатии, язвенной болезни желудка и двенадцатиперстной кишки, атеросклероза сосудов с развитием инфаркта и инсульта, синдрома беспокойных ног.
У детей почечная недостаточность приводит к задержке роста костной ткани.
Развитие почечной недостаточности у женщин во время беременности сопряжено с невынашиванием плода или формированием у него врожденных пороков.
Без лечения ХПН может закончиться смертью пациента от сердечно-сосудистых осложнений или уремической комы.
Диагностика
При первичном обследовании врач собирает анамнез заболевания, уточняя жалобы и давность симптомов. Далее проводятся осмотр кожных покровов, пальпация и поколачивание пальцами поясничной области.
Лечение почечной недостаточности
Обязательно проводятся диагностика и лечение патологии, послужившей причиной почечной недостаточности, а также устранение факторов риска.
При выраженном или длительном нарушении фильтрационной функции почек пациенту показано аппаратное очищение крови – гемодиализ. Процедура проводится регулярно и позволяет убрать из организма токсичные вещества. Альтернативой выступает перитонеальный диализ, при котором в брюшную полость вводится с последующим удалением специальный раствор, забирающий на себя вредные вещества.
В случае тяжелого течения хронической почечной недостаточности выполняется операция по трансплантации почки. После пересадки проводится курс терапии препаратами, подавляющими иммунитет, чтобы не произошло отторжения донорской ткани.
Диабетическая нефропатия: современные принципы классификации, диагностики и особенности сахароснижающей терапии

Статья посвящена современным подходам к терапии сахарного диабета, осложненного поражением почек. Сахарный диабет является важнейшей проблемой современной медицины, что прежде всего обусловлено высокой распространенностью заболевания среди трудоспособного
Abstract. The article is devoted to modern approaches to the treatment of diabetes mellitus complicated by kidney damage. Diabetes mellitus is the most important problem of modern medicine, which is primarily due to the high prevalence of the disease among the working-age population. Diabetic nephropathy is one of the severe chronic complications of diabetes, which increases the disability and mortality of patients. Diabetic nephropathy is the main cause of the development of end-stage renal failure in developed countries and eventually affects about 30% of patients. Kidney damage in patients with diabetes occurs in 6-7% of cases out of the total number of nephropathies in patients receiving treatment in a specialized nephrological department of a multidisciplinary hospital. The first manifestations of diabetic nephropathy develop 3-4 years after the onset of the disease, and reach their peak in 15-20 years. The concept of «chronic kidney disease» includes kidney damage regardless of the primary diagnosis and is characterized by such basic diagnostic criteria as urinary albumin excretion and glomerular filtration rate values, which are markers of kidney damage. Methods for preventing the progression of diabetic nephropathy include general measures to change the lifestyle, control of glycemia and blood pressure, correction of lipid metabolism disorders in combination with nephroprotective therapy. Currently, when choosing therapy in patients with type 2 diabetes mellitus in combination with chronic kidney disease, along with taking metformin, preference is given to sodium-glucose cotransporter type 2 inhibitors and glucagon-like peptide-1 receptor agonists with a nephroprotective effect. For citation: Borisov A. G., Chernavskiy S. V., Smirnova M. A., Stremoukhov A. A. Diabetic nephropathy: modern principles of classification, diagnosis and features of antihyperglycemic therapy // Lechaschy Vrach. 2021; 9 (24): 53-58. DOI: 10.51793/OS.2021.24.9.010
Pезюме. Статья посвящена современным подходам к терапии сахарного диабета, осложненного поражением почек. Сахарный диабет является важнейшей проблемой современной медицины, что прежде всего обусловлено высокой распространенностью заболевания среди трудоспособного населения. Диабетическая нефропатия – одно из тяжелых хронических осложнений диабета, повышающее инвалидизацию и смертность пациентов. Диабетическая нефропатия является основной причиной развития терминальной почечной недостаточности в развитых странах и со временем затрагивает около 30% пациентов. Поражение почек у больных сахарным диабетом встречается в 6-7% случаев из общего числа нефропатий у пациентов, получающих лечение в специализированном нефрологическом отделении многопрофильного стационара. Первые проявления диабетической нефропатии развиваются через 3-4 года от дебюта заболевания и достигают своего пика через 15-20 лет. Понятие «хроническая болезнь почек» включает в себя поражение почек независимо от первичного диагноза, характеризующееся такими основными диагностическими критериями, как экскреция альбумина с мочой и значения скорости клубочковой фильтрации, которые являются маркерами повреждения почек. Методы предупреждения прогрессирования диабетической нефропатии включают в себя общие мероприятия по изменению образа жизни, контроль гликемии и артериального давления, коррекцию нарушений липидного обмена в сочетании с нефропротективной терапией. В настоящее время при выборе терапии у больных сахарным диабетом 2 типа в сочетании с хронической болезнью почек наряду с приемом метформина предпочтение отдается ингибиторам натрий-глюкозного котранспортера 2-го типа и агонистам рецепторов глюкагоноподобного пептида-1, обладающим нефропротективным эффектом.
В настоящее время сахарный диабет (СД) является одной из актуальных проблем современной медицины. Прежде всего это связано с высокой распространенностью заболевания среди трудоспособного населения. Согласно прогнозам, к 2040 г. число людей, страдающих СД в возрасте 20-79 лет, увеличится до 642 миллионов [1, 2].
Немаловажным является и социально-экономическое значение заболевания. Развитие хронических осложнений СД существенно увеличивает раннюю инвалидизацию и смертность больных [3].
Наибольшая опасность, безусловно, связана с развитием сердечно-сосудистых осложнений (ССО) у данных пациентов. Также важное место в этом ряду занимает и диабетическая нефропатия (ДН), которая развивается приблизительно у 20,1% и 6,3% больных СД 1 и 2 типа соответственно [4, 5].
Изучение проблемы поражения почек при СД имеет длительную историю. Еще в 1836 г. британский врач Ричард Брайт отметил наличие у больных СД протеинурии (ПУ), что является признаком почечного повреждения [6]. В дальнейшем в 1936 г. американскими патологоанатомами P. Kimmelstiel и C. Wilson впервые была описана патоморфология почек у пациентов, страдающих СД [7].
У больных СД 2 типа осложнения ДН занимают третье место среди причин смерти после сердечно-сосудистых заболеваний (ССЗ) и злокачественных новообразований [1]. Кроме того, на сегодняшний день нефропатия, ассоции-рованная с СД 2 типа, является главной причиной терминальной почечной недостаточности (ТПН) в Европе, США и Японии [8]. Ранняя диагностика и своевременное обеспечение лечебно-профилактических мероприятий больным СД являются залогом предупреждения развития ДН.
Определение, распространенность и патогенез ДН
Под ДН понимают специфическое поражение всех структур почек (клубочков, канальцев, интерстиция и сосудов), возникающее при СД и сопровождающееся формированием узелкового гломерулосклероза, что может приводить к развитию ТПН, требующей проведения заместительной почечной терапии (диализ, трансплантация). Повреждение клубочков связано с утолщением их базальной мембраны, увеличением объема мезангиального матрикса и последующим развитием узелкового и/или диффузного интеркапиллярного гломерусклероза. Тубулоинтерстициальные изменения заключаются в дистрофии и атрофии эпителия канальцев, фиброзе интерстиция, а сосудистые – в развитии артериогиалиноза и артериосклероза. «Специфическое поражение структур почек» означает, что при отсутствии гипергликемии структурные изменения почек, характерные для СД, не выявляются [9].
Распространенность ДН непрерывно увеличивается, что происходит в результате взаимодействия генетических и средовых факторов у больных как с 1, так и со 2 типом СД. По международным данным максимальный пик развития ДН наблюдается при длительности заболевания от 20 до 30 лет и составляет при СД 1 типа 30-40%, а при СД 2 типа – 35-50%. В России распространенность ДН в среднем составляет при СД 1 типа 19%, при СД 2 типа – 8%. В то же время активный скрининг больных СД 2 типа показывает, что истинная распространенность ДН превышает зарегистрированную от 2 до 8 раз [10, 11].
Частота выявления ДН находится в тесной зависимости от длительности СД. Эта зависимость более изучена при СД 1 типа вследствие более точного определения дебюта заболевания. Частота развития ДН у больных с длительностью СД 1 типа до 10 лет составляет 5–6%, до 20 лет – 20–25%, до 30 лет – 35–40%, до 40 лет – 45%, а максимальный пик развития ДН приходится на сроки от 15 до 20 лет существования СД. Важно отметить, что наряду с классическим диабетическим гломерулосклерозом у больных СД 2 типа часто развивается поражение почек недиабетического генеза (хронический пиелонефрит, мочекаменная болезнь, ишемическая нефропатия и т. д.). Возможность сочетания нескольких форм нефропатии значительно повышает риск необратимого ухудшения функции почек. Установлено, что у пациентов с впервые выявленным СД 2 типа микроальбуминурия (МАУ) уже обнаруживается в 15-40% случаев, ПУ – в 7-10%, а хроническая почечная недостаточность (ХПН) – в 1%. Скорее всего это отражает позднюю диагностику ДН вследствие низкой информированности врачей первичного звена. При относительно точном определении времени дебюта СД 2 типа прослеживается такая же, как и при СД 1 типа, зависимость частоты развития ДН от длительности заболевания: 7-10% при длительности СД 5 лет, 20-35% – при длительности 20-25 лет и 50-57% – при более длительных сроках течения болезни [11].
По данным ГВКГ им. Н. Н. Бурденко доля больных с ДН среди всех пациентов, получающих лечение в нефрологическом отделении, составляет в среднем 6,4% (рис. 1).
В то же время обследование больных эндокринологического отделения ГВКГ им. Н. Н. Бурденко показало, что ДН диагностируется у 35,6% больных с СД 1 типа и 43,1% – СД 2 типа (рис. 2) при сроке заболевания 25 лет. Первые признаки ДН выявляются через 3-4 года от дебюта СД, и частота ее достигает максимума после 20 лет течения болезни.
ДН развивается под действием огромного ряда причин. Но из всего многообразия механизмов ее развития наиболее изученными и доказанными являются метаболические (гипергликемия, гиперлипидемия) и гемодинамические (внутриклубочковая гипертензия, артериальная гипертензия (АГ)).
Безусловно, одним из самых важных метаболических факторов, инициирующих повреждение почек, является гипергликемия. В условиях гипергликемии образуются стабильные продукты гликозилирования, которые приводят к нарушению конфигурации мембраны клубочков, пролиферации гладкомышечных клеток артериол и усилению перекисного окисления липидов. В конечном итоге происходит утолщение гломерулярной базальной мембраны и развитие гломерулосклероза. Кроме того, увеличивается экспрессия в подоцитах сосудистого эндотелиального фактора роста, который аутокринно усиливает свою активность и приводит к повреждению ткани почек [12].
Большую роль в развитии ДН играет гиперлипидемия. Окисленные липопротеиды низкой плотности, ростовые факторы и цитокины увеличивают синтез компонентов мезангиального матрикса, ускоряя склерозирование клубочков. В свою очередь липиды, профильтровавшиеся в первичную мочу, могут приводить к повреждению клеток почечных канальцев [13].
АГ у пациентов с СД является самым мощным фактором прогрессирования хронической болезни почек (ХБП), который во много раз превышает по своему влиянию гипергликемию и гиперлипидемию. Внутриклубочковая гипертензия является основным гемодинамическим фактором развития ДН, которая возникает вследствие токсического действия гипергликемии и активации вазодилатирующих гормонов с развитием дилатации приносящей клубочковой артериолы, с одной стороны, а с другой – за счет активации местного ангиотензина II с констрикцией выносящей почечной артериолы [14].
Классификация и клинические проявления ДН
Впервые детальная классификация стадий ДН была разработана датским исследователем С. Е. Mogensen в 1983 г. Основу ее составляли показатели функциональных и структурных изменений почек (изменения скорости клубочковой фильтрации (СКФ), утолщение базальных мембран клубочков, наличие МАУ или ПУ) [15].
До последнего времени в РФ использовалась классификация ДН от 2000 г., предусматривавшая следующие стадии: микроальбуминурии, ПУ с сохранной азотовыделительной функцией почек и ХПН [16].
Показатель креатинина сыворотки крови использовался долгое время как основной маркер нарушения азотовыделительной функции почек. Благодаря последним исследованиям стало ясно, что из-за компенсаторных возможностей почек его цифры долгие годы могут соответствовать нормальным значениям, в то время как СКФ уже снижена.
Современная классификация ДН основывается на принципах стадирования ХБП, которую возможно диагностировать, если в течение трех и более месяцев имеются отклонения в анатомо-морфологической структуре или функции почек вне зависимости от нозологического диагноза [9]. Уровень СКФ в настоящее время признан лучшим методом оценки функции почек в целом как у здоровых лиц, так и при различных заболеваниях. Именно ее уровень определяет различные стадии ХБП (табл. 1).
Оценка степени поражения почек у больных СД существенно изменилась. Произошел переход от изолированной оценки АУ/ПУ в качестве классического маркера ДН к определению стадии ДН в зависимости от уровня СКФ, дополняя ее индексацией АУ/ПУ. АУ/ПУ рассматриваются как маркеры патологии почек, которые отражают степень повреждения клубочкового аппарата почек (табл. 2).
По данным международных клинико-эпидемиологических исследований, ХБП регистрируется у 40-60% пациентов с СД 2 типа. По данным федерального регистра, в 2016 г. в среднем по РФ ХБП выявлялась у пациентов с СД 1 типа в 23% случаев и при СД 2 типа – в 6,9% случаев. СКФ менее 60 мл/мин у больных СД 1 типа с ДН встречается в 50-60% случаев при наличии стойкой ПУ и в 70–80% случаев – у пациентов с СД 2 типа [2].
По данным ГВКГ им. Н. Н. Бурденко, у 2/3 пациентов, получающих лечение в специализированном нефрологическом отделении с ДН, наиболее часто диагностируются ХБП на стадии 3-5 (табл. 3).
У этих пациентов, кроме типичных осложнений СД, имеется высокий риск развития ССО. Кроме того, наличие ХБП высоких градаций вносит ряд ограничений в возможности сахароснижающей терапии.
У ДН отсутствуют специфические симптомы, клиническую картину определяют собственно проявления СД, его осложнения и проявления ХБП. Основными клиническими проявлениями ХБП являются АУ/ПУ, АГ, анемия, электролитные нарушения, ацидоз, нарушения фосфорно-кальциевого обмена, может присутствовать отечный синдром вследствие формирования нефротического синдрома и/или задержки жидкости в организме.
Диагностика ДН
При появлении ПУ у больного СД с длительным анамнезом заболевания (более 10 лет), с выраженной диабетической ретинопатией и другими признаками микро- и макрососудистых осложнений диагноз ДН не вызывает сомнений. Для ее выявления выполняются обязательные методы лабораторной диагностики: определение соотношения альбумин/креатинин в утренней порции мочи, общеклинический анализ мочи с оценкой содержания белка, суточная ПУ, исследование осадка мочи, определение концентрации в сыворотке крови креатинина, мочевины и калия. При необходимости выполняются ультразвуковое исследование почек и сонографическое исследование почечных артерий.
В настоящее время в клинической практике для расчета СКФ у взрослого населения используют следующие расчетные формулы: Кокрофта–Голта 1976, MDRD 1999, CKD–EPI 2011.
Общепризнанным является тот факт, что наиболее точным расчетным методом определения СКФ является формула CKD–EPI [17].
СКФ = 141 × min(СКР/k, 1)a × max(СКР/k, 1) – 1,209 × 0,993возраст
[× 1,018 для женщин] [× 1,159 для лиц негроидной расы],
где СКР — креатинин сыворотки крови (мг/дл); k – 0,7 (для женщин) или 0,9 (для мужчин); a – коэффициент, равный – 0,329 (для женщин) или – 0,411 (для мужчин).
Поскольку в РФ величина креатинина измеряется в мкмоль/л, необходимо перевести ее в мг/дл, для этого значение нужно разделить на коэффициент 88,4 (т. е. 100 мкмоль/л соответствует 1,13 мг/дл).
Имеется ряд ситуаций, при которых расчетные методы применять не совсем корректно. К ним относятся:
В этих ситуациях СКФ необходимо определять с использованием клиренсовых методов (проба Реберга–Тареева).
Особенности сахароснижающей терапии при ДН
Принципы лечения ДН основаны на коррекции факторов прогрессирования ДН и ХБП с целью предупреждения развития ТПН и снижения риска ССО. Основными направлениями терапии являются компенсация нарушений углеводного, липидного, кальций-фосфорного обмена, анемии и достижение целевых значений АД.
Компенсация углеводного обмена играет ключевую роль в профилактике развития и замедлении прогрессирования ХБП у больных СД. Ряд клинических исследований показал, что строгий контроль гликемии позволяет не только предотвратить развитие ДН у лиц, не страдающих ею, но и затормозить прогрессирование этого осложнения у больных с АУ и ПУ. Это утверждение справедливо как для больных СД 1 типа (исследование DCCT), так и для больных СД 2 типа (исследование UKPDS) [11].
Прогрессирование азотемии, проявляющееся в снижении СКФ, значительно сужает спектр возможного применения пероральных сахароснижающих препаратов (табл. 4).
Клинические практические рекомендациии KDIGO (Kidney Disease Improving Global Outcomes Quality Initiative – Инициатива по улучшению глобальных исходов заболеваний почек) рассматривают гликемический контроль как часть мультифакторной интервенционной стратегии, направленной на контроль АД и кардиоваскулярного риска. В них определены целевые уровни HbA1c у лиц с СД и ХБП с учетом имеющихся рисков. HbA1c
* ФГБУ ГВКГ им. Н. Н. Бурденко МО России, Москва, Россия
** ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
Диабетическая нефропатия: современные принципы классификации, диагностики и особенности сахароснижающей терапии/ А. Г. Борисов, С. В. Чернавский, М. А. Смирнова, А. А. Стремоухов
Для цитирования: Борисов А. Г., Чернавский С. В., Смирнова М. А., Стремоухов А. А. Диабетическая нефропатия: современные принципы классификации, диагностики и особенности сахароснижающей терапии // Лечащий Врач. 2021; 9 (24): 53-58. DOI: 10.51793/OS.2021.24.9.010
Теги: сахарный диабет, почки, контроль гликемии, нефропротективная терапия




.png)
.gif)
.gif)
.gif)
.gif)
.gif)