Нефрокальциноз почек что это
Нефрокальциноз почек что это
а) Терминология:
1. Аббревиатура:
• Нефрокальциноз (НК)
2. Синонимы:
• Медуллярный нефрокальциноз, кортикальный нефрокальциноз
3. Определение:
• Кальцификация паренхимы почки
1. Общая характеристика:
• Важнейшие диагностические критерии:
о Наличие кальцификатов в паренхиме почки
• Локализация:
о Медуллярный НК (95%): кальцификация почечных пирамид
о Кортикальный НК (5%): кальцификаты в корковом веществе и по ходу центральных бертиниевых перегородок (колонн)
о Как корковая, так и медуллярная: встречается редко
• Размер:
о Почки часто имеют нормальные размеры и контуры
2. УЗИ при нефрокальцинозе:
• Серошкальное ультразвуковое исследование:
о Медуллярный нефрокальциноз:
— Диффузно повышенная эхогенность почечных пирамид ± акустическое затенение
— Нарушение нормальной кортико-медуллярной дифференциации
— Медуллярные кольца: гиперэхогенный ободок, окаймляющий почечные пирамиды.
— Медуллярная губчатая почка: гиперэхогенность почечных пирамид вне зависимости от наличия медуллярного неф-рокальциноза
— Некротический папиллит — отторгающиеся сосочки, визуализируемые в виде гиперэхогенных структур без акустического затенения в области пирамид:
Кальцифицированные отторгающиеся сосочки с дистальным акустическим затенением
Сближение прилежащих чашечек
Кистозные полости в почечных пирамидах
о Кортикальный нефрокальциноз:
— Гиперэхогенное корковое вещество ± акустическое затенение
о При сравнении УЗИ и КТ при индуцированном нефрокальцинозе у кроликов, УЗИ показало более высокую чувствительность (96% против 64%), а КТ-большую специфичность (96% против 85%)
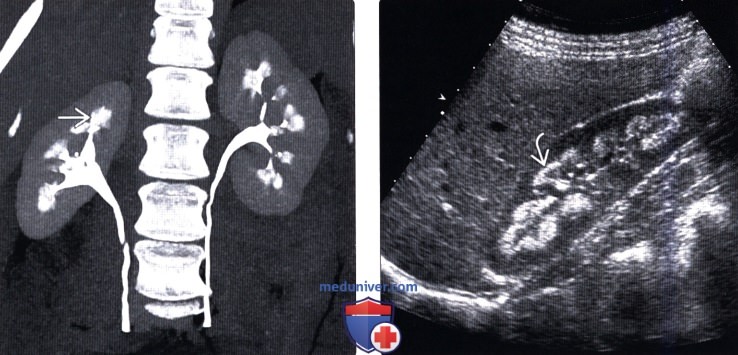
(Правый) На продольном УЗ срезе правой почки визуализируются гиперэхогенные пирамиды с нарушением нормальной кортико-медуллярной дифференциации. Обратите внимание на гиперэхогенный ободок, окаймляющий пирамиды.
3. Рентгенологические данные при нефрокальцинозе:
• Рентгенография:
о Медуллярный НК: точечная, крупнозернистая или сливная кальцификация пирамид
о Кортикальный НК:
— Диффузные затенения в почечной паренхиме
— Тонкий периферический кальцифицированный ободок, часто переходящий на перегородочное корковое вещество
— 2 тонкие, параллельные кальцифицированные линии (трамвайные пути)
— Точечная кальцификация, представляющая собой некротизированные канальцы коркового вещества (встречается наиболее редко)
• ЭУГ:
о Медуллярная губчатая почка (МГП):
— Легкая степень — внешний вид линейных «штрихов кистью» в почечных пирамидах вследствие попадания контраста в расширенные канальцы
— Средняя или тяжелая степень → при затекании контраста в кистозные расширения собирательных трубочек, они приобретают вид «букета цветов» и «гроздьев винограда»
— Плюсы: высокочувствительный метод визуализации расширенных собирательных трубочек
— Минусы: воздействие контраста и ионизирующего излучения; низкая чувствительность визуализации мелких конкрементов и нефрокальциноза; не используется в рутинной практике
4. КТ при нефрокальцинозе:
• КТ без контрастирования:
о Медуллярный НК: точечная, крупнозернистая или сливная кальцификация пирамид:
— Гиперпаратиреоз и почечный канальцевый ацидоз (ПКА) 1 типа — обычно диффузная, равномерная кальцификация:
Интенсивная сливная кальцификация мозгового вещества: часто встречается при почечном канальцевом ацидозе
— Медуллярная губчатая почка — часто асимметричная, сегментарная или односторонняя кальцификация:
Характерно наличие скоплений кальцификатов в сосочках
Высокая чувствительность для конкрементов, но низкая чувствительность для эктазии канальцев
Часто сочетается с медуллярным НК, который, однако, не является обязательным критерием диагностики МГП
— Некротический папиллит → грубо кальцинированные некротизированные сосочки (обычно при анальгетической нефропатии)
о Кортикальный НК: тонкая полоска или «трамвайные пути» кальцификатов коркового вещества с небольшими перпендикулярными расширениями в бертиниевы колонны
• КТ с контрастированием:
о МГП при КТ-экскреторной урографии (КТ-ЭУГ) = внешний вид «штрихов кистью» при легкой степени; появление симптома «букета цветов» или «гроздей винограда» в более тяжелых случаях:
— КТ-ЭУГ: высокочувствительный метод выявления конкрементов, медуллярных кист и дилатации собирательных канальцев; воздействие контраста и ионизирующего излучения
— Прогрессирующее поражение — деформация сосочков и чашечек
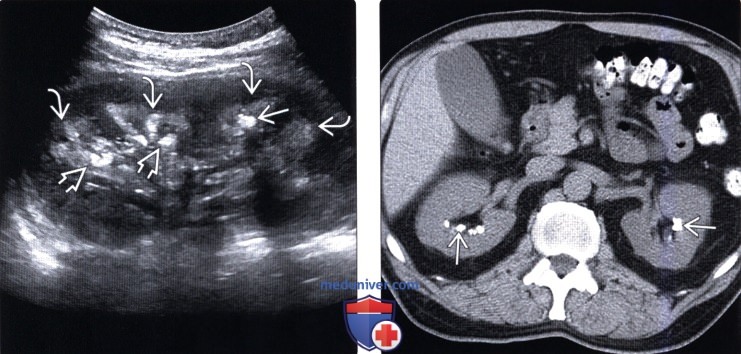
(Правый) Аксиальный КТ срез почек без контрастирования, визуализируются множественные конкременты в верхушках почечных пирамид с обеих сторон. Более крупные отложения кальция в почечных сосочках и неравномерная, асимметричная их локализация служат признаком медуллярной губчатой почки — одной из причин медуллярного нефрокальциноза.
в) Дифференциальная диагностика нефрокальциноза:
1. Конкремент почки:
• Однородный гиперэхогенный очаге выраженным задним акустическим затенением
2. Эмфизематозный пиелонефрит:
• Скопление газа в паренхиме почки в сочетании с «грязным затенением»
3. Гиперэхогенное мозговое вещество другой этиологии:
• Аутосомно-рецессивная поликистозная болезнь почек
• Гиперурикемия: подагра, синдром Леша-Нихена, гликогенозы (гиперэхогенное мозговое и корковое вещество)
• Гипокалиемия: первичный альдостеронизм, синдром псевдо-Бартерра
• Медуллярный нефросклероз
• Амилоидоз
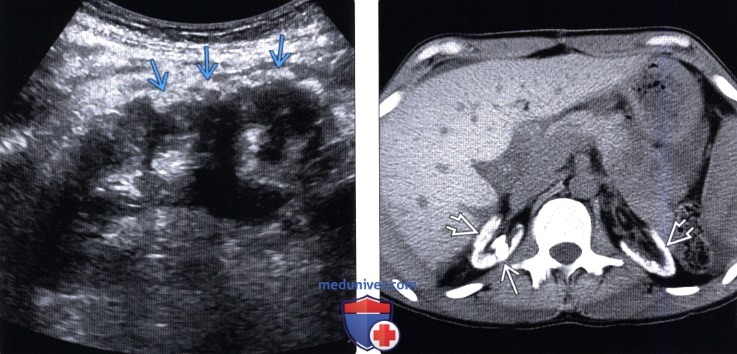
(Правый) Аксиальный КТ срез через почки без контрастирования, визуализируются атрофированные, повышенной плотности почки в результате оксалоза. Визуализируются также крупные, повышенной плотности конкременты в правой почке.
2. Микроскопия:
• Отложение кальция в интерстиции, эпителии канальцев, по ходу базальных мембран
• Отложение кальция в просвете канальцев
д) Клинические особенности:
1. Проявления:
• Наиболее распространенные симптомы:
о Обычно бессимптомное течение
о МГП может осложняться ИМПТ, гематурией, уролитиазом
2. Демография:
• Возраст:
о Любой
• Пол:
о М>Ж
3. Эпидемиология:
о Заболеваемость: 0,1-6%
о МГП: 0,5-1% в общей популяции:
— Причина МКБ приблизительно у 18% женщин и 12% мужчин
ж) Список использованной литературы:
1. Koraishy FM et al: СТ urography for the diagnosis of medullary sponge kidney. Am J Nephrol. 39(2): 165-70, 2014
2. Lee H: Nephrocalcinosis. In Kim S: Radiology Illustrated: Uroradiology. 2nd ed. Berlin: Springer. 528-49, 2012
3. Aziz S et al: Rapidly developing nephrocalcinosis in a patient with end-stage liver disease who received a domino liver transplant from a patient with known congenital oxalosis. J Ultrasound Med. 24(10): 1449-52, 2005
4. Kim YG et al: Medullary nephrocalcinosis associated with long-term furosemide abuse in adults. Nephrol Dial Transplant. 16(12):2303-9, 2001
5. Schepens D et al: Images in nephrology. Renal cortical nephrocalcinosis. Nephrol Dial Transplant. 15(7)4080-2, 2000
6. Dyer RB et al: Abnormal calcifications in the urinary tract. Radiographics. 18(6):1405-24, 1998
7. Toyoda K et al: Hyperechoic medulla of the kidneys. Radiology 173(2):431-4, 1989
Редактор: Искандер Милевски. Дата публикации: 14.11.2019
НЕФРОКАЛЬЦИНОЗ
Нефрокальциноз (греч. nephros почка + кальциноз) — диффузное отложение солей кальция в ткани почек, сопровождающееся воспалительно-склеротическими изменениями и почечной недостаточностью.
«Кальциевые метастазы» в почках наблюдал впервые Р. Вирхов. Термин «нефрокальциноз» ввел в 1934 г. Олбрайт (F. Albright). Из отечественных исследователей Нефрокальциноз изучали А. В. Русаков, О. K. Тиктинский. Цоллингер и Михач (H. U. Zollinger, М. J. Mihatsch, 1978) выявили Нефрокальциноз в 0,87% случаев (на 2080 биопсий почки).
Различают первичный Нефрокальциноз, возникающий в ранее не измененных почках, и вторичный Н., при к-ром инкрустируется солями некротизированная ткань почек. Выделяют также так наз. почечные кальцификаты, представляющие собой очаговые обызвествления некротизированной ткани в зоне ишемического инфаркта, туберкулезной каверны или опухоли. Сюда же следует отнести случаи тотального обызвествления одной почки при тяжелом поражении ее туберкулезом («омелотворенная почка»).
Содержание
Этиология и патогенез
Различают следующие этиологические факторы первичного нефрокальциноза. 1. Состояния, сопровождающиеся чрезмерным поступлением кальция в организм,— гипервитаминоз D, семейная и идиопатическая гиперкальциемия новорожденных, синдром Лайтвуда—Фанкони, синдром Бернетта, саркоидоз, болезнь Аддисона, неконтролируемое интравенозное введение солей кальция. 2. Состояния, сопровождающиеся мобилизацией кальция из костей,— гиперпаратиреоз, опухоли костей и нек-рых других органов, метастазы опухолей в кости, миеломная болезнь, острый, постклимактерический, посткастрационный и кортикостероидный остеопороз, множественные переломы костей, остеомиелит, иммобилизация, нейроплегия, болезнь Педжета, тиреотоксикоз. 3. Нарушение связывания кальция в костях — гипофосфатазия. 4. Патологическое осаждение кальция в тканях — оксалоз, цистиноз, кальцифилаксия. 5. Тубулопатии и другие заболевания, сопровождающиеся ацидозом,— преходящий канальцевый ацидоз Лайтвуда, хрон, канальцевый ацидоз Баттлера — Олбрайта, глюкозо-фосфат-аминоацидурия де Тони — Дебре — Фанкони, окулоцереброренальный синдром Лоу, гликогеноз Гирке, респираторный ацидоз, гиперхлоремический ацидоз.
Первичный Н. встречается при заболеваниях, сопровождающихся различными нарушениями кальциевого обмена, напр, чрезмерным поступлением кальция в организм, усиленной его резорбцией в кровь из костей, недостаточным извлечением из крови или патологическим осаждением в тканях. Весьма часто Н. встречается при врожденных и приобретенных заболеваниях почек, когда нарушена деятельность канальцев в отношении кальций-фосфорного гомеостаза.
Вторичный Н. развивается при ишемическом кортикальном некрозе почек; радиационном нефросклерозе; отравлении солями ртути; злоупотреблении сульфаниламидами, фенацетином, тиазидовыми, антраниловыми, этакриновыми диуретикамb; при применении амфотерицина.
К развитию Н. ведут почечные и внепочечные нарушения кислотнощелочного равновесия, гл. обр. респираторный и метаболический ацидоз (см.), реже метаболический алкалоз (см.). Почти при каждом из этих заболеваний наблюдается повышение уровня кальция в крови в сочетании с повышенной его экскрецией с мочой (гиперкальциурия) или без нее. Степень кальциурии может достигать 400—600 мг в 1 сут.
Усиленный приток кальция к почкам сопровождается накоплением его внутри клеток почечного эпителия. Когда концентрация внутриклеточного кальция достигает определенного предела, наступает дистрофия клеток, отложения кальция перемещаются в интерстициальное пространство или в просвет канальцев. Формирующиеся при этом цилиндры закупоривают канальцы, что способствует их дилатации и атрофии. Солевые депозиты в интерстиции вызывают лимфопролиферативную реакцию с последующим нефросклерозом. Кроме того, Нефрокальциноз предрасполагает к инфицированию и камнеобразованию, в связи с чем нередко возникают пиелонефрит и гидронефроз. При первичном Н. поражается вначале проксимальный отдел нефрона, дистальный отдел и клубочек вовлекаются в процесс позднее. При вторичном Н. кальций откладывается одновременно и в дистальном отделе нефрона.
Клинические проявления
Клинические проявления при Н. обычно сочетаются с симптомами основного заболевания и сопутствующей им гиперкальциемии (см.). Так, общая слабость, утомляемость, анорексия, тошнота, рвота, жажда, сухость кожи, зуд, запор, боль и деформация суставов, кератоконъюнктивит, психическая неустойчивость, атаксия, судорожные припадки, укорочение продолжительности систолы на ЭКГ обусловлены преимущественно интоксикацией кальцием. На поражение почек с нарушением транспорта веществ в канальцах и потерей чувствительности их к антидиуретическому гормону указывают полиурия, Изостенурия, полидипсия. Могут наблюдаться тупые боли в поясничной области и приступы почечной колики, связанные с отхождением конкрементов. Мочевой осадок бывает стойко измененным и содержит много лейкоцитов, бактерий, эритроцитов, солевых цилиндров. Протеинурия, отеки и артериальная гипертензия появляются позднее, когда уже могут быть выявлены клинические и лаб. признаки почечной недостаточности (см.).
Диагноз
Ранняя диагностика Н. возможна на основании пункционной биопсии почки. Обзорная рентгенография почек позволяет выявить лишь запущенные случаи со значительно выраженным обызвествлением почечных пирамид (рис.). Для ориентировочной оценки степени кальциурии может быть использована проба Сульковича (см. Сульковича проба). Уточнить причину Н. и функц, состояние почек помогает исследование крови и мочи на содержание кальция и фосфора, определение активности щелочной фосфатазы, паратгормона в крови, выделения оксипролина с мочой, клиренса креатинина и фосфата, кислотно-щелочного равновесия. Дифференцировать Н. следует с так наз. губчатой почкой, кистозные пространства к-рой заполнены конденсатом кальциевых солей.
Лечение
Необходимо своевременно устранить причину нарушения кальциевого обмена. В случае тяжелой дегидратации показано вливание р-ра гидрокарбоната или цитрата натрия, цитрата и аспарагината калия при ацидозе и хлорида натрия и аммония при алкалозе. При умеренно выраженной гиперкальциемии назначают диету с ограниченным содержанием кальция, вливание р-ра сульфата магния, витамин B6. При острой гиперкальциемии вливают р-ры фосфата натрия, сульфата магния, ЭДТА-натрия; вводят преднизолон, тирокальцитонин; при прогрессирующей почечной недостаточности проводят гемодиализ (см.). Особое внимание уделяют лечению пиелонефрита, способствующего прогрессированию почечной недостаточности. Кроме этого, при вторичном Н. проводятся мероприятия, направленные на лечение основного процесса.
Прогноз
Эффективное каузальное лечение на ранней стадии процесса улучшает состояние больного и функциональные показатели, почек; прогноз при прогрессировании H. неблагоприятный, т. к. в запущенном случае больному угрожает уремия.
Нефрокальциноз
Нефрокальциноз (греч. nephros почка + кальциноз) — диффузное отложение солей кальция в ткани почек, сопровождающееся воспалительно-склеротическими изменениями и почечной недостаточностью.
Различают первичный Н., возникающий в ранее не измененных почках, и вторичный Н., при котором инкрустируется солями некротизированная ткань почек.
Первичный Н. развивается при заболеваниях, сопровождающихся различными нарушениями фосфатно-кальциевого обмена с гиперкальциемией, в т.ч. при поражении костей (остеогенная нефропатия), в связи с чрезмерным поступлением кальция в организм, недостаточным извлечением его из крови или патологическим осаждением в тканях. Н. встречается при врожденных и приобретенных заболеваниях почек, когда нарушена деятельность канальцев (различные тубулопатии) в отношении кальций-фосфорного гомеостаза. Наиболее часто Н. развивается при гипервитаминозе D, саркоидозе, гиперпаратиреозе, остеопорозе, гипофосфатазии, оксалозе, цистинозе.
Вторичный Н. развивается при ишемическом кортикальном некрозе почек, радиационном нефросклерозе, отравлении солями ртути, злоупотреблении сульфаниламидами, фенацетином, тиазидовыми, антраниловыми, этакриновыми диуретинами, при применении амфотерицина В. Способствуют развитию Н. почечные и внепочечные нарушения кислотно-щелочного равновесия с гиперкальциемией, иногда также с гиперкальциурией.
Усиленный приток кальция к почкам сопровождается накоплением его внутри клеток почечного эпителия. Когда концентрация внутриклеточного кальция достигает определенного предела, наступает дистрофия клеток, отложения кальция перемещаются в интерстициальное пространство или в просвет канальцев. Формирующиеся при этом цилиндры закупоривают канальцы, что способствует их дилатации и атрофии. Солевые депозиты в интерстиции вызывают лимфопролиферативную реакцию с последующим нефросклерозом. Н. предрасполагает к камнеобразованию и инфицированию, в связи с чем нередко возникают пиелонефрит и гидронефроз. При первичном Н. поражается вначале проксимальный отдел нефрона; дистальный отдел и клубочек вовлекаются в процесс позднее. При вторичном Н. кальций откладывается одновременно и в дистальном отделе нефрона.
Клинические проявления при Н. обычно сочетаются с симптомами основного заболевания и сопутствующей им гиперкальциемии. Наблюдаются общая слабость, утомляемость, анорексия, тошнота, рвота, жажда, сухость кожи, зуд, запор, боль в суставах и их деформация, кератоконъюнктивит, психические нарушения, атаксия, судорожные припадки, укорочение продолжительности систолы на ЭКГ, обусловленные преимущественно интоксикацией кальцием. На поражение почек с нарушением транспорта веществ в канальцах и потерей чувствительности их к антидиуретическому гормону указывают полиурия, изостенурия (см. Диурез), полидипсия. Могут наблюдаться тупые боли в поясничной области и приступы почечной колики, связанные с отхождением конкрементов (см. Мочекаменная болезнь). Мочевой осадок бывает стойко измененным и содержит много лейкоцитов, бактерий, эритроцитов, солевых цилиндров. Протеинурия, отеки и артериальная гипертензия появляются позднее, когда уже могут быть выявлены клинические и лабораторные признаки почечной недостаточности.
Медикаментозная терапия поражений почек, обусловленных нарушениями обмена пуринов
Рассмотрены подходы к медикаментозному лечению пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов. Описаны лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии.
Approaches to drug treatment of patients with renal diseases caused by purines metabolism disorders, are examined. Medications used for pathogenic treatment of gouty nephropathy are described.
Пуриновый обмен представляет собой сложный каскад биохимических реакций, в котором принимают участие многие ферментные системы. Содержание пуринов в организме складывается из их поступления с продуктами питания и эндогенного синтеза. Большая часть солей мочевой кислоты — уратов — образуется эндогенно в процессе метаболизма нуклеиновых кислот, однако существуют и другие пути биосинтеза этих веществ. Во всех вариантах важнейшим промежуточным звеном является инозиновая кислота, которая в дальнейшем подвергается гидролизу. Образующийся гипоксантин под влиянием фермента ксантиноксидазы преобразуется в ксантин и мочевую кислоту. С точки зрения биохимии нарушения пуринового обмена представляют собой различные варианты дисбаланса между ферментными системами, отвечающими за синтез и транспортировку мочевой кислоты и ее предшественников. Существенное значение также имеет поступление значительного количества пуринов с продуктами питания.
Считается, что в организме взрослого здорового человека содержится около 1000 мг мочевой кислоты. При нарушениях обмена пуринов этот показатель может возрастать в несколько раз. Содержание мочевой кислоты в организме не является жестким параметром и не имеет какой-либо диагностической ценности. Даже основной показатель состояния пуринового обмена — концентрация мочевой кислоты в сыворотке крови особой жесткостью не отличается. Минимальное и максимальное значения нормы отличаются примерно в 2,5 раза — 200–450 мкмоль/л у мужчин и 160–400 мкмоль/сут у женщин. У здоровых людей за сутки выводится и вновь синтезируется примерно 750 мг или 2/3 от общего объема мочевой кислоты. Из этого количества около 80% или 600 мг экскретируется почками. Оставшиеся 20% выводятся через желудочно-кишечный тракт. По оценке П. М. Клименко и соавт. (2010) клиренс мочевой кислоты в норме составляет 5,4–9,0 мл/мин [1].
Почечная экскреция уратов представляет собой сложный и многоступенчатый процесс. В клубочках происходит фильтрация уратов плазмы. Попавшие в ультрафильтрат ураты практически полностью реабсорбируются в проксимальном канальце, а затем секретируются в просвет нефрона. Некоторая часть секретированных уратов повторно реабсорбируется. Процесс активной секреции уратов очень чувствителен к различным химическим агентам. Считается, что почечную секрецию уратов повышают оротовая кислота, лозартан, эстрогены, продукты распада тетрациклина (просроченные тетрациклины обладают высокой токсичностью!); почечную экскрецию уратов понижают этамбутол, тиазиды и тиазидоподобные диуретики, в меньшей степени фуросемид и ацетазоламид [2]. Вполне очевидно, что выраженность отмеченных эффектов сильно изменяется от препарата к препарату и далеко не всегда имеет клиническое применение. В частности, урикозурические свойства эстрогенов существенного значения не имеют. Лозартан в последнее время стал фигурировать в схемах лечения подагрического тубулоинтерстициального нефрита у пациентов, не имеющих нефролитиаза [3]. Склонность тиазидов и индапамида уменьшать почечную экскрецию уратов и повышать их сывороточную концентрацию выражена достаточно ярко, что делает эти препараты как минимум нежелательными при суставной подагре и, особенно, при подагрической нефропатии.
Клинические варианты поражения почек вследствие нарушения пуринового обмена
Заболевания, связанные с нарушениями пуринового обмена, встречаются сравнительно часто, что делает актуальными вопросы, связанные с их лечением. Специалисты-урологи, а также большинство врачей общей практики хорошо знакомы с особенностями уратного нефролитиаза. В то же время эти специалисты нередко вовсе не имеют представления о существовании других, подчас более тяжелых заболеваний, обусловленных нарушениями пуринового обмена. Между тем все они встречаются с разной частотой в стационарах, а также при оказании амбулаторной медицинской помощи.
Наиболее значимым следствием нарушений пуринового обмена является повышение уровня мочевой кислоты в крови — гиперурикемия, которая и является основным этиологическим фактором различных патологических состояний. В зависимости от этиологии гиперурикемия подразделяется на первичную (не имеющую явной причины) и вторичную по отношению к какому-либо заболеванию.
Клиническим следствием первичной гиперурикемии является подагра в широком понимании этого термина. Сюда входит и классический острый микрокристаллический артрит, и различные варианты подагрической нефропатии, одним из которых является уратный нефролитиаз, и тофусы различной локализации, и осложнения всех этих состояний.
В группе заболеваний, связанных с первичной гиперурикемией, несколько особняком стоят генетически обусловленные нарушения пуринового обмена. Среди них синдром Леша–Нихена, болезнь Гирке, различные варианты наследственных дефектов транспортных систем почечных канальцев и другие. Отличительными признаками гиперурикемий, наследуемых по моногенному типу (то есть связанных с дефектом конкретного гена, определяющего развитие всего симптомокомплекса), являются манифестация в раннем детском возрасте, высокая гиперпродукция мочевой кислоты, быстрое, иногда даже «злокачественное» прогрессирование заболевания вплоть до формирования терминальной почечной недостаточности, часто весьма умеренная эффективность лечебных мероприятий, несмотря на максимально активную терапию [4].
Клиническая диагностика нарушений пуринового обмена, наследуемых по полигенному типу, в настоящее время затруднена. Проявления и характер течения заболевания в этом случае сильно варьируют в зависимости от внешних факторов, а биологический эффект значительной части генов все еще не до конца ясен [3, 4].
В нефрологической и общетерапевтической практике для определения поражения почек вследствие гиперурикемии несколько десятилетий назад было введено понятие «подагрическая почка», которое в современной медицине трансформировалось в «подагрическую нефропатию». Учитывая экспериментально доказанное повреждающее действие солей мочевой кислоты на почечные структуры, также предлагался термин «уратная нефропатия». Все эти понятия являются обобщающими и объединяют несколько достаточно сильно различающихся по своему патогенезу процессов: острую мочекислую нефропатию, уратный нефролитиаз и хронический тубулоинтерстициальный нефрит. Отдельные авторы также отмечают возможность иммунокомплексного гломерулонефрита, пусковым фактором которого служит гиперпродукция мочевой кислоты [5].
В урологической практике наиболее часто встречаются пациенты с уратным нефролитиазом. До 80% таких пациентов хотя бы один раз в жизни имели эпизод острого артрита, причем совершенно необязательно классической локализации — I плюснефалангового сустава. В последнее время все чаше встречаются атипичные варианты подагрического артрита, например, гонит. Кроме того, широкое и бесконтрольное применение нестероидных противовоспалительных средств зачастую смазывает клиническую картину, увеличивая удельный вес артритов с меньшей активностью воспалительного процесса. Можно отметить, что сочетание артрита и уратного нефролитиаза является не обязательным, а, скорее, характерным [5, 6].
Клиническая картина конкремента почки, мочеточника общеизвестна, поэтому еще раз ее подробно описывать смысла нет. Единственно, стоит отметить, что при наиболее тяжелом, «злокачественном» течении, наряду с образованием уратных камней в просвете мочевых путей, возможно и отложение кристаллов урата в почечном интерстиции, что носит название «нефрокальциноз». В отличие от нефролитиаза, нефрокальциноз при подагре всегда двухсторонний. Нефрокальциноз не имеет каких-либо специфических симптомов. Клинические проявления сводятся к прогрессированию почечной недостаточности за счет нефросклероза. Нефрокальциноз в большинстве случаев выявляется при ультразвуковом сканировании и требует специфической терапии.
Хронический тубулоинтерстициальный нефрит является характерным и частым вариантом подагрической нефропатии. Однако, ввиду меньшей яркости клинической картины, он известен главным образом специалистам-нефрологам и ревматологам.
На начальных стадиях тубулоинтерстициального нефрита патологический процесс затрагивает в основном канальцы и почечный интерстиций, поэтому ведущим симптомом является нарушение концентрационной функции почек — полиурия с низкой плотностью мочи (гипостенурией). Протеинурия не превышает 1 г/сут или вовсе отсутствует — она связана с нарушением реабсорбции белка канальцами. Для подагрического интерстициального нефрита характерна стойкая уратурия, а также стойкая или эпизодическая микрогематурия, особенно после перенесенной респираторной вирусной инфекции.
Уровень урата крови также закономерно повышен, однако необходимо помнить, что сам по себе факт наличия хронической почечной недостаточности также является причиной гиперурикемии. При явной клинической картине хронического тубулоинтерстициального нефрита его связь с нарушениями пуринового обмена не вызывает сомнений при следующих соотношениях уровней урата и креатинина крови: соответственно > 536 мкмоль/л и 595 мкмоль/л и 132–176 мкмоль/л; > 714 мкмоль/л и > 176 мкмоль/л [7].
При иммуногистохимическом исследовании почечных биоптатов у части пациентов с клинической картиной подагрического тубулоинтерстициального нефрита было отмечено свечение С3-фракции комплемента и IgG, что характерно для иммунокомплексных гломерулонефритов. Это позволило выделить хронический гломерулонефрит как отдельный вариант подагрической нефропатии [6].
При прогрессировании подагрического тубулоинтерстициального нефрита закономерно развитие артериальной гипертензии и нефросклероза.
Острая мочекислая нефропатия (острая подагрическая почка) в своей основе имеет обструкцию почечных канальцев кристаллами уратов, что приводит к острой почечной недостаточности. Заболевание начинается с олигурии. Часть пациентов одновременно предъявляет жалобы на болевой синдром по типу почечной колики, макрогематурию, что может объясняться миграцией крупных кристаллов уратов по мочеточнику. Патогномоничной является высокая уратурия, не характерная для острой почечной недостаточности другой этиологии, а также значительное повышение уровня мочевой кислоты в крови (выше 850–900 мкмоль/л). В современной нефрологической практике считается, что диагноз острой мочекислой нефропатии не вызывает сомнений при соотношении уровней урата и креатинина крови (в мг) > 1 [8].
Предположение об острой мочекислой нефропатии основывается на сочетании трех клинических признаков — высокоактивного артрита с характерной локализацией, резкого уменьшения диуреза и кирпично-бурого цвета мочи. Диагноз тем более вероятен, если пациент указывает на имевшую место гипогидратацию любого генеза — от посещения бани и физической работы при высокой температуре воздуха до неадекватной инфузионной терапии и передозировки мочегонных, а также на употребление значительного количества мясных продуктов и/или алкоголя. При естественном течении заболевания олигурия практически всегда прогрессирует до анурии с развернутой клинической картиной острой почечной недостаточности.
Проблема острой мочекислой нефропатии тесно прилежит к вторичным гиперурикемиям. Причины повышения уровня мочевой кислоты в сыворотке крови довольно многочисленны и разнообразны. Среди них: хроническая почечная недостаточность, независимо от этиологии, ожирение, особенно высоких степеней, плохо компенсированный сахарный диабет, акромегалия, гипотиреоз, гипопаратиреоз, токсикоз беременности, миелопролиферативные заболевания, саркоидоз, хроническая интоксикация свинцом, хронический алкоголизм. Прослеживается четкая связь между повышенным риском уратного нефролитиаза и наличием у пациента тяжелого псориаза, особенно суставного. В большинстве случаев выраженность гиперурикемии при этих заболевания небольшая, реже умеренная. Таким образом, нарушения пуринового обмена довольно редко значимо отражаются на клинической картине заболевания.
Самым ярким и клинически значимым вариантом вторичной гиперурикемии является «синдром лизиса опухоли» («синдром распада опухоли»), развивающийся при химиотерапии и радиотерапии лимфопролиферативных заболеваний, реже опухолей другой локализации. Ключевым компонентом этого синдрома, наряду с гиперфосфатемией и гиперкалиемией, является гиперпродукция мочевой кислоты, приводящая к развитию острой мочекислой нефропатии, причем нередко на неизмененных почках [11]. Однако тяжелая гиперурикемия, обусловленная генетическими нарушениями, крайне редко приводит к острой мочекислой нефропатии [3, 4].
Медикаментозная терапия заболеваний почек, обусловленных нарушениями пуринового обмена
Консервативная терапия любого варианта подагрической нефропатии в основе своей имеет снижение уровня гиперурикемии, а следовательно, и гиперурикурии, а также повышение растворимости урата в моче.
Всем пациентам в обязательном порядке назначается диета, цель которой уменьшить поступление пуринов в организм с пищей. Это достигается полным исключением из рациона мяса молодых животных, субпродуктов, мясные бульоны, колбас и т. д., ограниченно разрешается мясо полновозрастных животных, рыба. Пациентам рекомендуется преимущественно растительный стол, обильное щелочное питье, цитрусовые и напитки на их основе, а также полное воздержание от алкоголя.
При наличии почечной недостаточности, артериальной гипертензии, недостаточности кровообращения, ожирения вводятся дополнительные ограничения. Прежде всего, рекомендуют снизить потребление поваренной соли, так как эффективность ингибиторов АПФ, особо показанных при нефропатиях, осложненных артериальной гипертензией, да и вообще всей гипотензивной терапии напрямую зависит от объема поступающего в организм натрия. При выраженном дефиците фильтрации появляется необходимость в ограничении потреблении белка. При ожирении уменьшают общую калорийность рациона.
У ряда пациентов, например, при редко рецидивирующем уратном нефролитиазе без почечной недостаточности, при достаточной мотивации со стороны больного, вообще удается ограничиться коррекцией диеты и питьевого режима, не прибегая к назначению лекарственных препаратов.
Лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии, подразделяются на:
Базовым препаратом, влияющим на метаболизм пуринов, является аллопуринол, являющийся ингибитором фермента ксантиноксидазы. Под действием этого фермента происходит последний этап синтеза мочевой кислоты. Предшественники урата ксантин и гипоксантин имеют практически в 10 раз более высокую растворимость в воде по сравнению с мочевой кислотой. Остановка метаболизма пуринов на этом этапе сводит практически до нуля риск кристаллообразования, а значит, и микрокристаллического артрита, и нефропатии.
Аллопуринол показан при подагрическом тубулоинтерстициальном нефрите, острой мочекислой нефропатии, уратном нефролитиазе в сочетании с гиперурикемией, а также при химиотерапии злокачественных новообразований для профилактики развития вторичной гиперурикемии и острой почечной недостаточности. Минимально эффективная дозировка — 200 мг/сут, среднетерапевтическая — 300–400 мг/сут. При химиотерапии злокачественных новообразований требуются высокие, близкие к максимальным, дозировки аллопуринола — 600–900 мг/сут [2].
Аллопуринол склонен вызывать диспептические расстройства и кожную сыпь, которые отмечаются практически у каждого пятого больного. Побочные действия этого препарата чаще носят характер неприятных, но не опасных, и ввиду практически полной (вплоть по последнего времени) безальтернативности этого препарата большая часть пациентов все-таки продолжает лечение.
В последнее время на отечественном рынке появился новый ингибитор ксантиноксидазы фебуксостат, который отличается от аллопуринола более высокой селективностью [3]. Отечественный опыт применения фебуксостата пока крайне ограничен, однако зарубежные исследователи отмечают его более высокую эффективность в отношении гиперурикемии [9]. Однако уже сейчас можно отметить, что этот препарат является полноценной заменой аллопуринола в условиях его непереносимости, аллергии и т. д.
В заключение необходимо отметить, что ингибиторы ксантиноксидазы противопоказаны пациентам, получающим азатиоприн и 6-меркаптопурин, так как этот фермент принимает участие в их метаболизме. При совместном назначении резко возрастает риск токсичности, прежде всего костномозговой.
За рубежом также применяется рекомбинантная уратоксидаза — расбуриказа. Препарат существенно эффективнее аллопуринола снижает гиперурикемию и применяется, главным образом, в гематологической практике для профилактики острой уратной нефропатии [3].
Лекарственные средства, увеличивающие почечное выведение пуринов, — урикозурические препараты — угнетают процесс реабсорбции урата из просвета почечных канальцев. В современной клинической практике эта группа лекарственных средств применяется очень ограниченно. Далеко не у всех пациентов они демонстрируют достаточную эффективность. Кроме того, результатом прямого фармакологического эффекта — увеличения почечной экскреции урата — является рост риска нефролитиаза. Самый известный урикозурический препарат — пробенецид в настоящее время практически отсутствует на отечественном рынке. Бензбромарон зарегистрирован в России, но имеется лишь в очень небольшом количестве. Все урикозурические средства в организме подвергаются печеночному метаболизму и обладают некоторой гепатотоксичностью. Еще одной особенностью этих препаратов является огромное число лекарственных взаимодействий, что затрудняет их применение в составе многокомпонентных схем.
Цитратная терапия является неотъемлемой составляющей медикаментозного лечения подагрической нефропатии. Действие солей лимонной кислоты на процесс кристаллобразования в моче многогранно. Растворимость мочевой кислоты значительно меняется в зависимости от реакции среды. В кислой среде ураты имеют очень плохую растворимость и легко переходят в твердую фазу — кристаллизуются. При нейтральной или щелочной реакции растворимость этих солей увеличивается. Основным эффектом цитратов является способность защелачивать мочу, что предотвращает кристаллизацию уратов и создает условия для растворения уже сформированных кристаллов. На этом основана литолитическая терапия. Однако при щелочной реакции среды уменьшается растворимость фосфатов. Наслоение пленки фосфата на уратный камень делает практически бесперспективным процесс дальнейшего литолиза. Это диктует необходимость тщательного контроля за реакцией мочи на протяжении всего курса лечения. В современных условиях на смену эмпирическому применению растительного сырья, богатого лимонной кислотой и ее солями, пришли лекарственные средства, включающие в себя химически чистый цитрат и набор тест-полосок для мониторирования реакции мочи.
Исследования 1980–90-х гг. продемонстрировали эффективность литолиза уратных камней с применением цитратных смесей в режиме монотерапии порядка 75–80% [10, 11]. В настоящее время в результате совершенствования методики эффективность литолиза удалось повысить до 85–90% в зависимости от особенностей химического состава конкрементов [1, 12, 13].
В последние годы появились работы, свидетельствующие о целесообразности включения препаратов цитрата в многокомпонентные схемы терапии. В частности, при уратных камнях мочеточника, особенно его дистальной трети, комбинированная терапия, включающая цитрат и тамсулозин, привела к самостоятельному отхождению 84,8% конкрементов, что достоверно отличается от групп пациентов, получавших монотерапию этими препаратами (68,8% и 58,8% соответственно), а также от пациентов, получавших плацебо (26,1%) [14].
Имеются убедительные доказательства эффективности комбинации аллопуринола и цитрата при подагрическом интерстициальном нефрите. Двенадцатинедельный курс комбинированной терапии, включающей цитрат 3 г/сут и аллопуринол 100–200 мг/сут, привел к росту скорости клубочковой фильтрации в среднем на 15 мл/мин по сравнению с контрольной группой. Также существенно повысился и клиренс мочевой кислоты. Отметим низкую дозировку аллопуринола. Минимально эффективной считается 200 мг/сут, а 100 мг/сут — вообще субклиническая дозировка, тем не менее, она оказалась эффективной. Можно сделать предположение о возможном потенцировании эффектов аллопуринола и цитрата. Дополнительным позитивным следствием должно быть снижение частоты побочных действий аллопуринола, что является существенным лимитирующим фактором при медикаментозном лечении подагрической нефропатии. К сожалению, авторы не акцентировали на этом внимание [15].
Более яркий эффект цитрата в отношении функции почек отмечен при лечении хронического интерстициального нефрита, обусловленного гиперурикемией, у пациентов, страдающих ожирением [16].
Механизм действия цитрата не ограничивается защелачиванием мочи. Цитрат является одним из физиологических ингибиторов кристаллообразования. Так как моча в норме представляет собой пересыщенный солевой раствор, присутствие в ней ингибиторов кристаллообразования служит необходимым условием адекватного функционирования всей системы мочевыделения. Гипоцитратурия является одним из факторов, способствующих камнеобразованию. Этим может объясняться эффективность цитратных смесей не только при уратном, но и при кальций-оксалатном нефролитиазе [17–19].
Наряду с вышеописанными механизмами действия, соли лимонной кислоты дополнительно обладают антисептическим, цитопротективным и метаболическим эффектами, которые также могут находить применение в клинической практике. В частности, C. Strassner и A. Friesen сообщают об исчезновении кандидурии у 16 пациентов из 18 на фоне терапии цитратными смесями, что, вероятно, связано с изменением реакции мочи [20]. Заключение о цитопротективном эффекте цитрата сделано на основании успешных попыток P. Bruhl и соавт. предотвращать с его помощью химическую травму слизистой мочевого пузыря при терапии препаратами из группы оксазафосфоринов — циклофосфамидом и ифосфамидом [21] (в современной онкологической и нефрологической практике с этой целью применяется препарат из группы муколитиков — месна, практически не влияющий на кислотно-щелочное состояние). Кроме того, сообщается об использовании цитрата для коррекции ацидоза вследствие уретеросигмостомии [22].
Основная сложность при цитратной терапии уратного нефролитиаза заключается в подборе адекватной дозировки препарата. Н. К. Дзеранов, на протяжении многих лет изучавший и разрабатывавший этот аспект, рекомендует начинать с назначения диеты и оценки реакции мочи в течение 5 дней в строго определенное время суток. На основании полученных средних значений уровня рН мочи определяется начальная доза препарата и, главное, ее распределение в течение суток. Через 5 дней лечения снова определяются средние показатели реакции мочи в строго аналогичное время суток и, при необходимости, проводится коррекция дозировки препарата [23]. «Интерактивное», то есть в реальном времени, изменение дозировки цитрата неэффективно и даже небезопасно, так как приводит к скачкам уровня рН, что может вызвать кристаллизацию фосфата.
Ввиду того, что цитрат в норме присутствует в организме, лекарственные средства на его основе практически лишены токсичности. Тем не менее, существуют клинические ситуации, когда применение этих препаратов требует осмотрительности. Применение цитратных смесей нежелательно при острой мочекислой нефропатии и вообще при острой почечной недостаточности любой этиологии. Лимитирующим фактором здесь выступает не цитрат-ион, а калий, выведение которого в этой клинической ситуации затруднено. При острой мочекислой нефропатии целесообразно введение 4% раствора гидрокарбоната натрия, физиологического раствора и т. д. в сочетании с петлевыми диуретиками. Необходимо поддерживать диурез на уровне не менее 100–150 мл/час, рН мочи не ниже 6,5. При возможности назначаются ингибиторы ксантиоксидазы. Цитратные смеси целесообразны при восстановлении диуреза и достижении скорости клубочковой фильтрации 25–30 мл/мин, когда риск гиперкалиемии практически отсутствует [5, 6].
При тяжелой недостаточности кровообращения лимитирующим фактором является повышенное поступление в организм натрия, также содержащегося в цитратных смесях. Иногда в этой ситуации предпочтительнее оказывается ацетазоламид. Данный препарат из группы диуретиков — ингибиторов карбоангидразы сильно, а главное, неконтролируемо защелачивает мочу, что делает его неконкурентоспособным по сравнению с цитратом при медикаментозной терапии уратного нефролитиаза. Однако ацетазоламид — практически единственная возможность повысить уровень рН мочи, не прибегая к введению солей, что в условиях тяжелой сердечной недостаточности крайне нежелательно.
Таким образом, медикаментозное лечение пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов, несмотря на весьма ограниченный выбор лекарственных препаратов и кажущуюся простоту их выбора, представляет собой сложную и многогранную проблему, требующую междисциплинарного подхода.
Литература
ФГБУ НИИ урологии МЗ РФ, Москва
