стеноз легких что это
Изолированный стеноз клапана легочной артерии
При этом пороке три створки клапана легочной артерии — пути нормального выброса крови из правого желудочка — плохо развиты, сращены друг с другом и часто представляют собой просто мембрану с отверстием в центре. Величина этого отверстия может быть разной — от 1-1,5 мм до почти нормальной, и оно может быть сужено только в местах соединения створок со стенкой легочной артерии. Соответственно, и состояние сердца, и клинические проявления этого, достаточно частого, порока будут совершенно различны.
Когда створки клапана почти полностью сращены между собой и создают огромное препятствие току крови из правого желудочка, то в первые дни жизни состояние ребенка будет очень тяжелым, а после закрытия артериального протока, т.е. на 5-7 день жизни, может стать критическим и потребовать немедленных действий. Дети с критическим типом стеноза легочной артерии в половине случаев живут меньше месяца. Но сегодня ранняя гибель таких детей не может иметь никаких оправданий, потому что экстренная операция не только возможна, но и очень проста и может быть выполнена в рентгенохирургическом кабинете. Методика вмешательства разработана хорошо — при катетеризации сердца через имеющееся отверстие в диафрагме «клапана» проводится катетер с баллоном, расширение которого разрывает сращенные створки и увеличивает отверстие.
Если нет возможности применить эту методику, то можно рассечь створки хирургическим путем. Но это уже, пусть и простая, без применения искусственного кровообращения, но — операция, хотя при этом пороке риск ее гораздо меньше, чем при стенозе аортального клапана.
О проявлениях критического состояния ребенка мы говорили ранее, касаясь других пороков. Здесь только скажем, что признаки тяжелой сердечной недостаточности — одышка, отеки, увеличение печени — могут появиться уже в первые дни, а грубый шум над областью сердца и «дрожание» над его областью мать может почувствовать и прослушать ухом уже почти сразу после рождения. При этом дети — не синюшны. Цианоз появляется на 2-3 неделе, да и то не слишком выраженный, т.к. потоки артериальной и венозной крови хорошо смешиваются в предсердиях через открытое овальное окно.
Точный диагноз устанавливается при эхокардиографическом исследовании и, если он установлен, и нет сопутствующих пороков, то надо вмешиваться быстро.
К счастью, такое проявление порока бывает в меньшинстве случаев изолированного стеноза легочного клапана. Как правило, диагноз этот устанавливают позже — в 1-2 года, да и то, нередко, случайно. И это объяснимо, т.к. давление в правых отделах невысокое в сравнении с левыми, степень сужения может быть совершенно разной, а наличие дрожания над сердцем само по себе ни о чем не говорит.
Из-за затрудненного оттока правый желудочек работает с постоянной перегрузкой, что довольно быстро приводит к увеличению размеров его полости и утолщению его стенки. Поэтому надо постоянно наблюдать за течением болезни, которая часто, кроме этого шума, ничем себя не проявляет и никак не сказывается на росте, развитии и поведении ребенка. В какой-то момент, возможно в течение первых 10 лет, возникнет вопрос об операции. Он встанет тогда, когда разница давлений между правым желудочком и легочной артерией, или так называемый «градиент на клапане» достигнет определенного уровня — 50-60 мм рт. ст. Его измеряют ультразвуком довольно точно.
Операция, в простых случаях будет заключаться в рассечении сращенных створок. Но, если порок существовал долго (несколько лет), то иногда придется иссечь и мышечные пучки, образовавшиеся из-за утолщения стенки правого желудочка, или даже рассечь кольцо легочной артерии — место крепления створок — и вшить туда небольшую заплатку, расширив, таким образом, выход.
В любом случае, особенно затягивать с хирургией не стоит. Сегодня вам могут предложить рентгенохирургическое расширение клапана — без операции. Но выбор метода целиком зависит от конкретных условий, и, как бы то ни было, следует ожидать только хорошего результата – ведь в остальном сердце совершенно нормально.
Однако, при устранении сужения простым разрывом или рассечением слитых между собой створок, их нормальное строение не восстанавливается. Со временем у больного могут развиться признаки недостаточности клапанов, т.к. они хоть и хорошо пропускают кровь, но нормально не захлопываются. Недостаточность легочного клапана гораздо менее «агрессивна» в своих клинических проявлениях, чем аортального, но иногда, через много лет после первой операции, может встать вопрос о замене плохо работающего клапана на протез.
Показания к такой операции строго индивидуальны, и ее можно рекомендовать только тогда, когда все методы консервативной терапии исчерпаны, а сердечная недостаточность нарастает. Риск такой повторной операции невысок, а результаты ее достаточно хорошие.
Стеноз легких что это
Резюме Стеноз легочной артерии представляет собой достаточно редкое состояние, которое может приводить к постановке ошибочных диагнозов, особенно у взрослых. Стеноз легочной артерии в детском возрасте часто ассоциируется с другими синдромами, однако этиология данной патологии у подростков и взрослых остается до конца не изученной. В данной статье обсуждаются потенциальные проблемы эхокардиографической диагностики стеноза легочной артерии. Ретроспективный анализ протоколов 2030 эхокардиографических исследований, выполненных в детском и подростковом возрасте, выявил слабую отрицательную связь максимальной скорости кровотока (Vmax) на клапане легочной артерии (КЛА) (в PW-режиме) с возрастом (r=–0,15; р
Врожденная патология сердца, с точки зрения ЭхоКГ, достаточно широко и полно освещена в большинстве руководств по ультразвуковой диагностике. При этом отдельные аспекты диагностики сердечно-сосудистой патологии либо не анализируются вовсе, либо затрагиваются частично, например коронарные фистулы и стеноз легочной артерии (СЛА). В доступных отечественных [1] и зарубежных [2, 3] руководствах, за исключением Х. Фейгенбаума [4], нет ни одного изображения данного порока ни в B-, ни в PW–/CW-режимах. За кадром остаются как патогенетические составляющие данной патологии, так и диагностические подходы по ее верификации. Подобная ситуация, вероятно, обусловлена небольшим числом больных в популяции и объединением больных с СЛА с пациентами из группы стеноза клапана легочной артерии (КЛА). По данным Nadas` Pediatric Cardiology (США) [5], доля таких пациентов среди всех лиц с врожденными пороками сердца (ВПС) достигает 6,8%, что может составлять всего 8,8 случая ВПС типа «стеноза КЛА/ЛА» всех степеней тяжести в год на 1 млн населения. Российские данные по частоте таких стенозов значительно меньшие — всего 1,2% [6], что составляет 3 случая на 1 млн населения. Таким образом, подобные случаи в практической деятельности врачей были и остаются единичными, однако это не умаляет значимости данной патологии. На практике, как правило, имеет место описание «вероятной клапанной патологии ЛА», когда в CW-режиме регистрируется ускоренный кровоток, который в ряде случаев обусловлен гиперволемией на фоне другой кардиальной патологии (дефект межжелудочковой (ДМЖП) и межпредсердной (ДМПП) перегородок) или физиологическими особенностями младенческого возраста, о чем будет сказано ниже. Кроме того, может описываться сужение ствола ЛА без приведения нормативных значений для данного возраста/массы тела и тем более площади поверхности тела (ППТ). Но ни в одном доступном руководстве такие данные не приводятся.
Наиболее полно причины регистрации ускоренного кровотока на КЛА изложены в руководстве по эхокардиографии М.К. Рыбаковой [1]. Однако и в нем стенозу ствола ЛА в виде «мембраны в стволе» уделено лишь несколько строк без демонстрации клинических случаев возможных вариантов стеноза Л.А. Данная статья — попытка исправить сложившееся положение, обобщив доступные данные и дополнив их собственными наблюдениями.
Морфология
Чтобы понять причину возникновения СЛА, а также особенности локализации таких поражений, следует обратиться к основам эмбриологии. Образование легочного ствола и легочных артерий в норме происходит из четырех основных компонентов: 1) клапан и проксимальная часть легочного ствола формируются из луковицы сердца (артериальный бульбус); 2) дистальная часть ствола — результат деления артериального ствола; 3) главные ветви легочной артерии — из шестых парных аортальных (жаберных) дуг; 4) внутрилегочные сегменты легочных артерий — из зачатка легочного сосудистого сплетения.
На протяжении пренатального онтогенеза на морфологическую структуру легочного ствола оказывают влияние те гемодинамические условия, в которых находится этот магистральный сосуд малого круга кровообращения. Строение легочного ствола, с одной стороны, напоминает строение других крупных сосудов, с другой — проявляется специфическими особенностями, которые возникают на разных стадиях внутриутробного развития по мере роста плода, причем его изменения имеют неравномерный характер. Проведенные электронно-микроскопические исследования легочного ствола показали, что процесс формирования в его стенке волокнистых структур и внеклеточного основного вещества тесно связан с дифференцировкой эндотелия, фиброцитов и гладкомышечных клеток [7]. Ситуация, отчасти схожая с вышеизложенной, наблюдается и при развитии коарктации аорты [8] — сужение аорты формируется в месте соединения 4-й и 6-й дуг аорты с ее нисходящим отделом (место соединения разных эмбриональных зачатков).
Патогенез периферических стенозов легочной артерии до конца не известен. Однако на примере синдрома врожденной краснухи видно, что воздействие вируса на процесс формирования эластической ткани, возможно, является принципиальным механизмом развития этой патологии. Гистологические изменения в аорте и больших сосудах проявляются фокальным утолщением интимы, потерей фиброэластической ткани, фрагментацией эластических волокон, вакуолизацией «медии». В мелких сосудах в патологический процесс также вовлекается внутренняя эластическая пластина. Помимо этого следует отметить, что сосудистые пороки являются следствием дефицита гена эластина и нарушения генной продукции тропэластина, который принимает участие в формировании архитектуры эластических волокон сосудов [9].
Приобретенное сужение ЛА наблюдается после паллиативных и восстановительных хирургических вмешательств: системно-легочных анастомозов, суживания ЛА, унифокализации при атрезии ЛА с ДМЖП, операций артериального переключения при транспозиции магистральных артерий и отхождении обоих крупных сосудов от правого желудочка с подлегочным ДМЖП, при этапной одножелудочковой коррекции. Сужение артерий изредка возникает при фиброзирующих медиастинитах или при опухолях средостения вследствие наружного сдавления.
Стеноз периферических легочных артерий часто сочетается с синдромом Noonan, Alagille, cutis laxa, Ehlers-Danlos [10], Уильямса—Беурена [11]. Тяжелая легочная гипертензия с множественными периферическими стенозами легочной артерии может наблюдаться у пациентов с интра- и экстракраниальной артериопатией [12]. Данный вариант ангиопатии, ассоциированной с геном RNF213 (p.Arg4810Lys), выявляется при болезни мойя-мойя. Также описывается связь периферического СЛА с делецией хромосомы 16 [13]. Отмечается также связь периферического СЛА с синдромом Алагилла и другими ВПС [14].
Анатомия
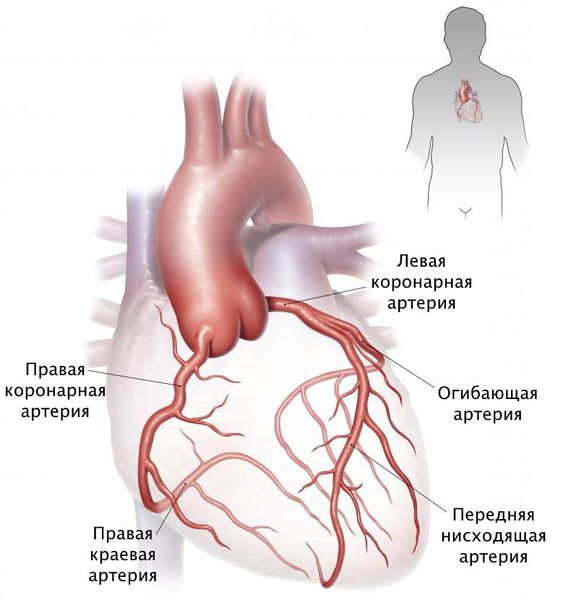
В норме легочная артерия всегда больше аорты. Однако это превалирование должно быть не более чем в 1,3 раза. Обнаружение диспропорции диаметров главных артерий (диаметр легочной артерии существенно больше аорты или диаметр аорты больше легочной артерии) является важным диагностическим критерием их аномалий. Расширение легочной артерии при нормальных размерах восходящей аорты чаще всего отмечается при объемной перегрузке правого желудочка и стенозе клапана легочной артерии. О нормальных размерах аорты в этих случаях судят по отношению ее размеров к диаметру верхней полой вены. Расширение восходящей аорты и сужение легочной артерии позволяют диагностировать как тетраду Фалло, так и изолированную гипоплазию легочной артерии.
Стеноз ствола ЛА относится к I типу (IA) стенозов Л.А. Стеноз может быть в виде диафрагмы внутри сосуда или протяженного уменьшения диаметра артерии. Тип II представляется гипоплазией бифуркации ЛА с вовлечением в процесс дистальной части легочного ствола и устьев обеих ветвей. Протяженность сужения варьирует от короткого локального стеноза до длинного сегмента обструкции.
В норме диаметр устья легочной артерии составляет более 80% диаметра устья аорты. В связи с этим степени стеноза легочной артерии [15] подразделяются на:
1) легкий, умеренный стеноз — диаметр устья легочной артерии составляет от 50 до 80% диаметра устья аорты;
2) тяжелый стеноз — диаметр устья легочной артерии составляет менее 50% диаметра устья аорты.
Принято считать, что стеноз является легким, если давление в правом желудочке не достигает 70 мм рт.ст., тяжелым при давлении свыше 100 мм рт.ст. Гипоплазия ствола легочной артерии и его ветвей почти всегда сочетается с клапанным или инфундибулярным стенозом легочной артерии.
Взаимоотношения между стволом легочной артерии и ее клапаном следующие: имеется сильно выраженная тенденция к уменьшению просвета сосуда с уменьшением числа створок и увеличением степени стеноза клапана легочной артерии [15].
Степени гипоплазии ствола легочной артерии подразделяются на:
1) умеренную гипоплазию — диаметр ствола легочной артерии составляет от 50 до 80% диаметра аорты;
2) выраженную гипоплазию — диаметр ствола легочной артерии составляет менее 50% диаметра аорты.
Существует также заметная тенденция к тому, чтобы просвет ветвей правой и левой легочной артерии был прямо пропорционален просвету ее ствола, хотя наблюдаются отдельные случаи выраженной гипоплазии ствола при гораздо меньшей степени гипоплазии его ветвей [15]. В некоторых случаях стеноза клапана легочной артерии наблюдается постстенотическое расширение, т. е. относительный размер ствола легочной артерии непропорционально увеличен относительно ее устья.
Дети с легким и умеренным стенозом легочной артерии могут вести нормальный образ жизни, поэтому во время беременности лишь следят за развитием порока, и только в послеродовом периоде решается вопрос о кардиохирургической операции.
Не стоит забывать и о том, что у новорожденных часто наблюдается физиологическое сужение легочной артерии, обусловленное относительной гипоплазией ее ветвей. В большинстве случаев оно уменьшается с ростом ребенка и к 6-месячному возрасту должно полностью исчезнуть [16, 17]. Клинически сужение проявляется преходящим систолическим шумом. Эхокардиографические исследования показали, что при наличии шума размеры легочного ствола и ветвей меньше, чем у детей без шума, и в среднем составляют 60% от ожидаемой нормы. ЭхоКГ с допплерографией обнаруживает турбулентный характер кровотока и значительно большую скорость кровотока в ветвях ЛА. К 3-месячному возрасту у 70% детей шум исчезает, увеличивается размер ветвей и снижается скорость кровотока.
При закрытии артериального протока у здорового ребенка может развиться сужение левой легочной артерии, но особенно часто (до 36%) — у больных с клапанным стенозом или атрезией легочной артерии. Механизмы развития сужения левой ЛА и коарктации аорты идентичны и связаны с артериальным протоком. При посмертных гистологических исследованиях стеноза ЛА обнаруживалась ткань протока в стенке ЛА со стороны протока. Описан случай локального сужения обеих ветвей ЛА в месте впадения билатерального боталлова протока. Его роль в механизме сужения левой ветви показана при допплерографических исследованиях недоношенных детей до и после закрытия протока [18]. У каждого третьего ребенка возникал значимый преходящий стеноз левой ЛА. В правой ЛА градиент давления не выявлялся.
Эхокардиографическая диагностика
Различные варианты стеноза ствола ЛА в виде мембраны, сужения ствола на всем протяжении, локального уплотнения и утолщения (чаще на удалении 1—2 см от клапана ЛА) относятся к надклапанным стенозам. Мембрана чаще неполная, с перфорацией, которая, как правило, хорошо видна в В-режиме при условии, что врач-исследователь точно знает и понимает, что и где смотреть в случае локального ускорения потока в стволе ЛА. В режиме цветного сканирования регистрируется ускорение потока выше мембраны, а также локальное сужение (одностороннее, симметричное) конфигурации цветового потока в стволе ЛА в случае получения изображения хорошего качества (рис. 1). 


Считается, что порок можно увидеть лишь тогда, когда имеется уменьшение диаметра сосуда более чем на 1/3 по сравнению с нормой. Ключом к диагностике является комплексный учет данных. Важное дополнительное значение имеет эхокардиографическое исследование в PW–/CW-режимах, которое при значимом стенозе позволяет выявить локальное ускорение и турбулентный характер кровотока в месте сужения. За последние 11 лет нами было выявлено 11 человек с незначительными стенозами ствола ЛА, стенозом проксимального отдела ветви ЛА, и несколько человек после оперативного лечения тяжелого стеноза ЛА, но с сохранившимся незначительным стенозом ствола. Наиболее интересные и показательные случаи приведены ниже. На рис. 1 и 2 представлены варианты стеноза ствола ЛА в виде «неполной фиброзной мембраны» и «фиброзной перетяжки/тяжа».
Один из вариантов стеноза ЛА, зафиксированный у ребенка 1-го года жизни, находившегося в дальнейшем под наблюдением на протяжении 4 лет, приведен на рис. 3.
Нормативные данные, приводимые в руководствах по эхокардиографии, оказались крайне скудными. Так, У. Вилкенсхоф и соавт. [2] приводят нормативные значения только для диаметра ЛА на уровне створок КЛА только для взрослых лиц (в В-режиме — 1,5—2,5 см). Что касается данных Х. Фейгенбаума [4], то и там нормативные значения, приводимые только для правой ветви и ствола ЛА, даются на примере небольшой группы лиц (n=25) в возрасте 19—30 лет (1,2±0,2 и 2,0±0,4 см соответственно). Нормативные значения диаметра ствола ЛА у детей от рождения до 15-летнего возраста, по данным R. Meyer [19], оказались следующими: до 3-месячного возраста — 1,2±0,2; 4—12 мес — 1,25±0,09; 1—2 года — 1,41±0,33; 3—5 лет — 1,73±0,21; 6—10 лет — 1,96±0,4; 11—15 лет — 2,18±0,14 и старше 15 лет — 2,25±0,55 см.
Наиболее полные данные, касающиеся анатомии ЛА, приводятся M. Pettersen и соавт. [20] (см. таблицу). 
Что касается скорости потоков, регистрируемых на КЛА у детей и подростков, то здесь следует отметить следующее. Наш многолетний опыт работы показывает, что нормативные данные, приводимые в большинстве руководств, оказываются заниженными относительно фактически получаемых значений. Нами была проведена оценка максимальной скорости кровотока (Vmax) на КЛА в PW-режиме у детей (n=2030) в возрасте от 2 нед до 16 лет. Корреляционный анализ позволил выявить лишь слабую отрицательную связь линейной скорости кровотока (ЛСК) на КЛА с возрастом (r= –0,15; р
Что такое стеноз коронарных артерий? Причины возникновения, диагностику и методы лечения разберем в статье доктора Тарасовой Анастасии Николаевны, кардиолога со стажем в 15 лет.
Определение болезни. Причины заболевания
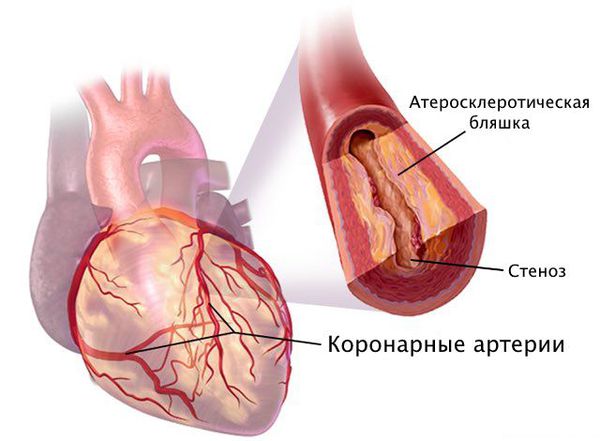
Стеноз коронарных артерий — это стойкое сужение просвета сосудов, по которым к сердцу поступает кислород и питательные вещества, необходимые для его нормальной работы. При сужении этих артерий сердце продолжает работать в обычном режиме, но постепенно перестаёт справляться со своими функциями в полной мере, из-за чего начинает страдать весь организм: нарушается объём циркулирующей крови, состояние сосудов и внутренних органов.
К основным причинам сужения сердечных артерий относятся:
Р едкие причины сужения сердечных артерий:
К факторам риска относятся:
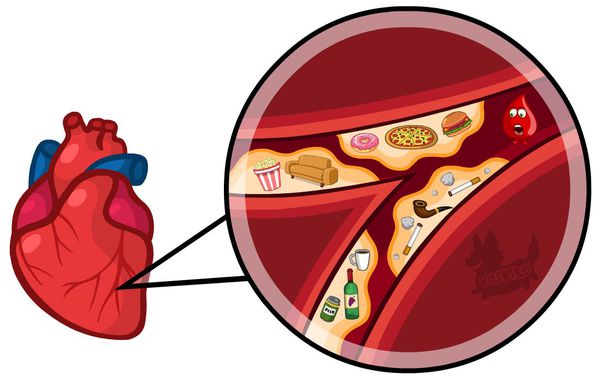
Наиболее частая причина стеноза — атеросклероз. С возрастом холестериновые бляшки прикрепляются к внутренней стенке сосуда, увеличиваются и значительно сужают его просвет, тем самым затрудняя движение крови.
Симптомы стеноза коронарных артерий
Болезнь часто проявляет себя не сразу, так как развивается стеноз довольно медленно и долго — десятки лет.
На ранних этапах симптоматика размытая. Нередко признаки болезни проявляются только во время физических нагрузок. В таком случае присутствует:
При развитии хронической сердечной недостаточности к этим симптомам присоединяется отёк ног.
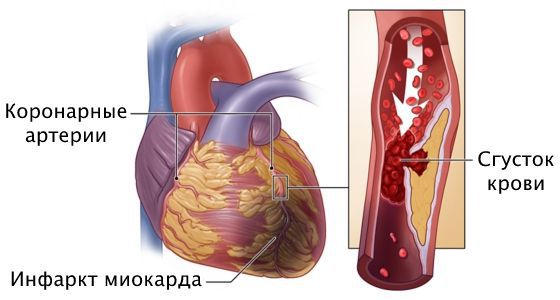
При прогрессировании стеноза происходит полное закупоривание артерии, вызывая некроз сердечной мышцы, т. е. гибель отдельных участков сердца. Это приводит к инфаркту миокарда и острой сердечной недостаточности. В таком случае загрудинная боль становится ещё сильнее, артериальное давление падает ниже 90 мм рт. ст. или на 30 мм рт. ст. ниже нормы, пациента «бросает в пот», ему не хватает воздуха, возникает слабость, тревога, нарушается сердечный ритм. Возможна потеря сознания вплоть до смертельных исходов. Эти симптомы могут наступить молниеносно или развиваться в течение нескольких часов или дней.
Почему признаки стеноза чаще проявляется только при физической нагрузке?
Дело в том, что при хронической ишемии сердца, которая развивается на фоне стеноза, организм начинает активно использовать компенсаторные механизмы: в кровотоке возникают обходные пути, которые без определённой физической нагрузки полностью или частично сглаживают проявления стеноза.
Патогенез стеноза коронарных артерий
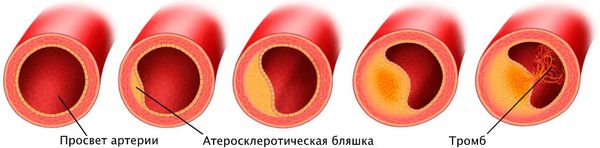
Патогенез стеноза при атеросклерозе связан с атеросклеротической бляшкой. Её увеличение уменьшает просвет артерии и снижает кровоснабжение сердца.
Поражение сердечных сосудов при атеросклерозе начинается с повреждения сосудистой стенки и увеличения концентрации в крови «плохого» холестерина — липопротеинов низкой плотности. Эти причины приводят к скоплению липопротеинов в области трещины стенки сосуда. Сливаясь между собой, они срастаются слоем соединительной ткани.
Выделяют три стадии развития атеросклероза:
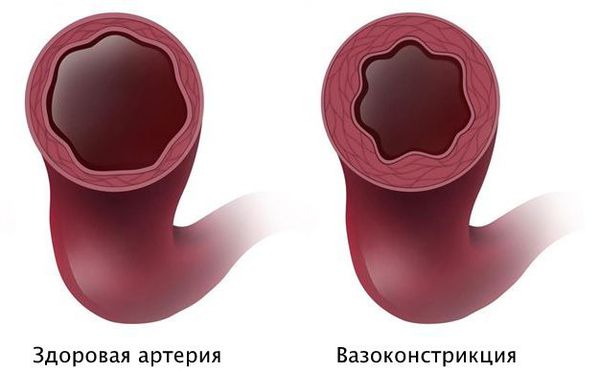
Вероятно, атеросклероз нарушает функциональное состояние артерий или вызывает склеивание тромбоцитов с выделением тромбоксана, который способствует вазоспазму — непроизвольному сокращению мышечного слоя артерии.
В то же время, при атеросклерозе без признаков стеноза вазоспазм может привести к значимому снижению кровотока. Кроме того, вазоспазм бывает причиной тяжёлых аритмий у людей с неизменёнными коронарными артериями.
Патогенез стеноза при спазме коронарных артерий связан с повышенной склонностью к вазоконстрикции — сужению просвета из-за временного гипертонуса сосудистой стенки. Возникающий вазоспазм способствует локальному склеиванию тромбоцитов и развитию инфаркта миокарда.
Короткий интенсивный спазм артерии может быть сле дствием дисфункции эндотелия, когда внутренняя оболочка сосуда не может нормально выполнять свои функции.
К другим факторами развития спазма относят:
Классификация и стадии развития стеноза коронарных артерий
Стенозы коронарных артерий различают по локализации и степени сужения.
По локализации выделяют:
По степени сужения артерий различают:
Осложнения стеноза коронарных артерий
Сужение сердечных артерий может проявиться в виде стабильной/нестабильной стенокардии или безболевой ишемии миокарда — гипоксии сердца. Без адекватного лечения стеноз может вызвать инфаркт миокарда и острую сердечную недостаточность с летальным исходом.
Стенокардия — это приступы боли или сдавления за грудиной с иррадиацией в область челюсти, шеи, левой руки, предплечья и живота. Этот приступ провоцируют:
Безболевая ишемия миокарда проявляется в виде сильной утомляемости и одышки. Иногда провоцирует развитие сердечной недостаточности. В патогенезе такой ишемии не исключена роль генетической недостаточности рецепторов восприятия боли — ноцицепторов.
Нестабильная стенокардия включает в себя:
Вазоспастическая спонтанная стенокардия возникает из-за спазма коронарных артерий, чаще в состоянии покоя. Как правило, вазоспазм развивается в поражённых, суженных атеросклерозом артериях в связи с их повышенной чувствительности к сосудосуживающим воздействиям. При этом на ЭКГ не появляются признаки инфаркта миокарда, хотя клинические проявления этой болезни схожи с симптомами такой стенокардии.
Инфаркт миокарда — это омертвение участка сердечной мышцы из-за острого нарушения кровоснабжения. При развитии этого осложнения самочувствие человека резко ухудшается, загрудинная боль усиливается, длится 20 минут и больше, возникает одышка, падает артериальное давление, проступает холодный пот, нарушается сердечный ритм, кожа бледнеет, человек может потерять сознание. Требуется экстренная госпитализация в отделение реанимации или кардиологии. Промедление чревато летальным исходом.
Причина инфаркта — стремительная закупорка сердечной артерии. Этому событию предшествует атеросклероз с вазоспазмом, тромбоз, эмболии или воспаление стенок артерий.
Диагностика стеноза коронарных артерий
Во время опроса пациента врач должен обратить внимание на характер и локализацию боли, её провоцирующие факторы, связь с физической нагрузкой, эффективность приёма нитратов для купирования боли и т. д.
Однако зачастую стеноз коронарных артерий протекает бессимптомно и проявляет себя только при остром тромбозе. Поэтому в диагностике болезни важны клинические данные и инструментальные методы исследования:
Перед коронарографией обязательно проводятся нагрузочные тесты и стресс-ЭхоКГ. Они помогаю определить, нужна пациенту эта процедура или нет.
Нагрузочные тесты включают велоэргометрию и тредмил-тест. Они представляют собой запись ЭКГ во время бега на беговой дорожке или езды на велотренажёре. Это позволяет оценить изменения ЭКГ на фоне физической нагрузки.
Стресс-ЭхоКГ — ультразвуковое исследование сердца во время нагрузки: медикаментозной или физической. Медикаментозная нагрузка показана пациентам, которые не могут перенести другой вид нагрузки. Она включает приём специальных препаратов, например добутамина.
Выявить стеноз коронарных артерий также помогают:
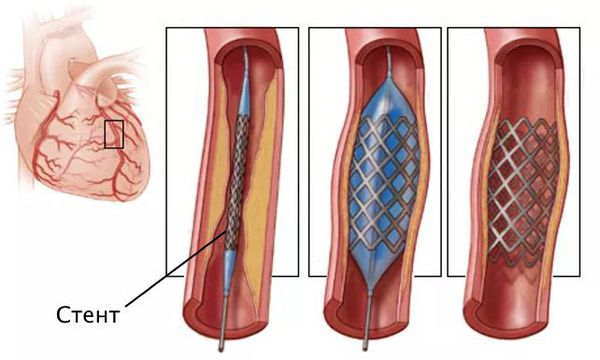
При подтверждении ишемии выполняют коронарную ангиографию с возможным стентированием — установкой специального каркаса (стента) в просвет поражённого сосуда.
Лечение стеноза коронарных артерий
Выделяют две группы методов лечения:
Длительность приёма у каждого препарата разная. Коррекция доз и замена лекарств производится строго под контролем врача.
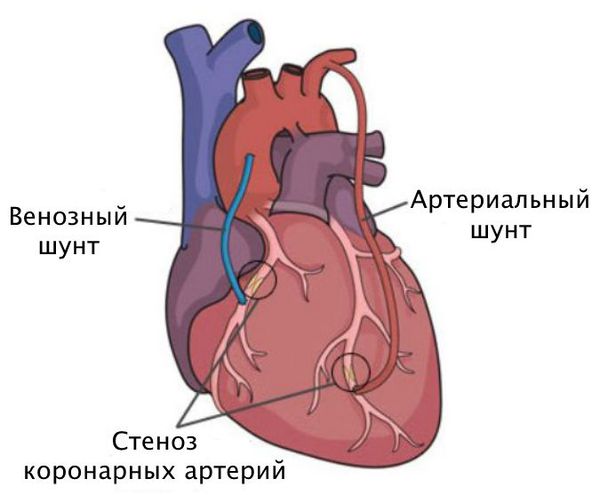
Хирургическое лечение включает два основных вида воздействия на стеноз коронарных артерий:
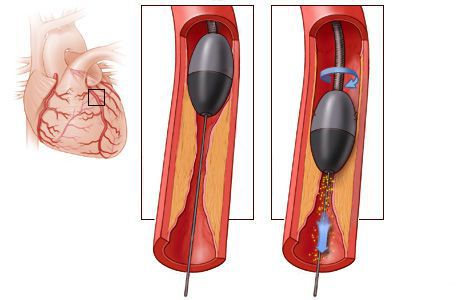
Стентирование предполагает установку стента в суженный сосуд. С тент представляет собой металлический каркас. При помощи проводника через бедренную или лучевую артерию этот каркас продвигают до поражённой коронарной артерии, фиксируют там и расправляют. Он не даёт артерии сужаться и нормализует кровоток.
Стентирование производится как планово для профилактики инфаркта миокарда, так и экстренно. Операция малоинвазивная: не требует обширных разрезов и общего наркоза.
Шунтирование направлено на создание нового пути кровотока в обход закупоренного сосуда. Материалом для шунта служат собственные вены и артерии пациента. Хирург подшивает их выше и ниже сужения коронарной артерии.
Прогноз. Профилактика
В основе профилактики лежит комплекс мероприятий по предотвращению сужения коронарных артерий. Это:
Обследование включает общеклинические анализы, исследование липидного профиля, ЭКГ, УЗИ сердца, суточное мониторирование ЭКГ и нагрузочные пробы. При необходимости проводится стресс-ЭхоКГ, МРТ сердца и мультиспиральная КТ коронарных артерий, по показаниям — коронароангиография.