Ознакомьтесь с химической лабораторной посудой подумайте для чего предназначен каждый ее образец
Цель: изучить основные виды химической посуды, лабораторного оборудования и правил работы с ними.
Знакомство с лабораторным штативом. Устройство лабораторного штатива.
Объясните, почему подставка штатива изготавливается массивоной?
Для увеличения устойчивости.
Задание 1. Знакомство с устройсвом штатива.
Снимите с установленного на столе штатива лапку и кольцо. Для этого ослабьте винст крепления муфты со стержнем и, поднимая муфту с лапкой или кольцом вверх, снимите ее со стержня штатива. Освободите лапку и кольцо от муфты: поверните против часовой стрелки винт, удерживающий лапку и кольцо, и выньте их из муфты. Наденьте муфту на стержень штатива так, чтобы винт, закрепляющий ее, был слева от стержня, а стержни лапки или кольца укреплялись бы таким образом, чтобы их поддерживал не только винт, но и муфта
Почему стержни лапок и колец располагаются сверху муфты?
Чтобы они не упали, если будут плохо закреплены.
Задание 2. Пользование штативом.
1. Почему закрепленная в лапке пробирка должна сравнительно свободно поворачиваться?
Чтобы при нагревании стекло не лопнуло.
2. Заполните таблицу 3.
Химическая посуда.
| НАЗВАНИЕ | РИСУНОК | МАТЕРИАЛ | НАЗНАЧЕНИЕ |
| мерный цилиндр |  | стекло | для отмеривания определеного объема жидкости |
| реторта |  | стекло | для перегонки жидкостей |
| круглодонная колба |  | стекло | проведение реакция, перегонка жидкостей |
| плоскодонная колба |  | стекло | для проведения химических реакций без нагревания |
| коническая колба |  | стекло | для жидкостей |
| пробирка |  | стекло | для проведения реакций с небольшим количеством реактивов |
| химический стакан |  | стекло | для жидкостей |
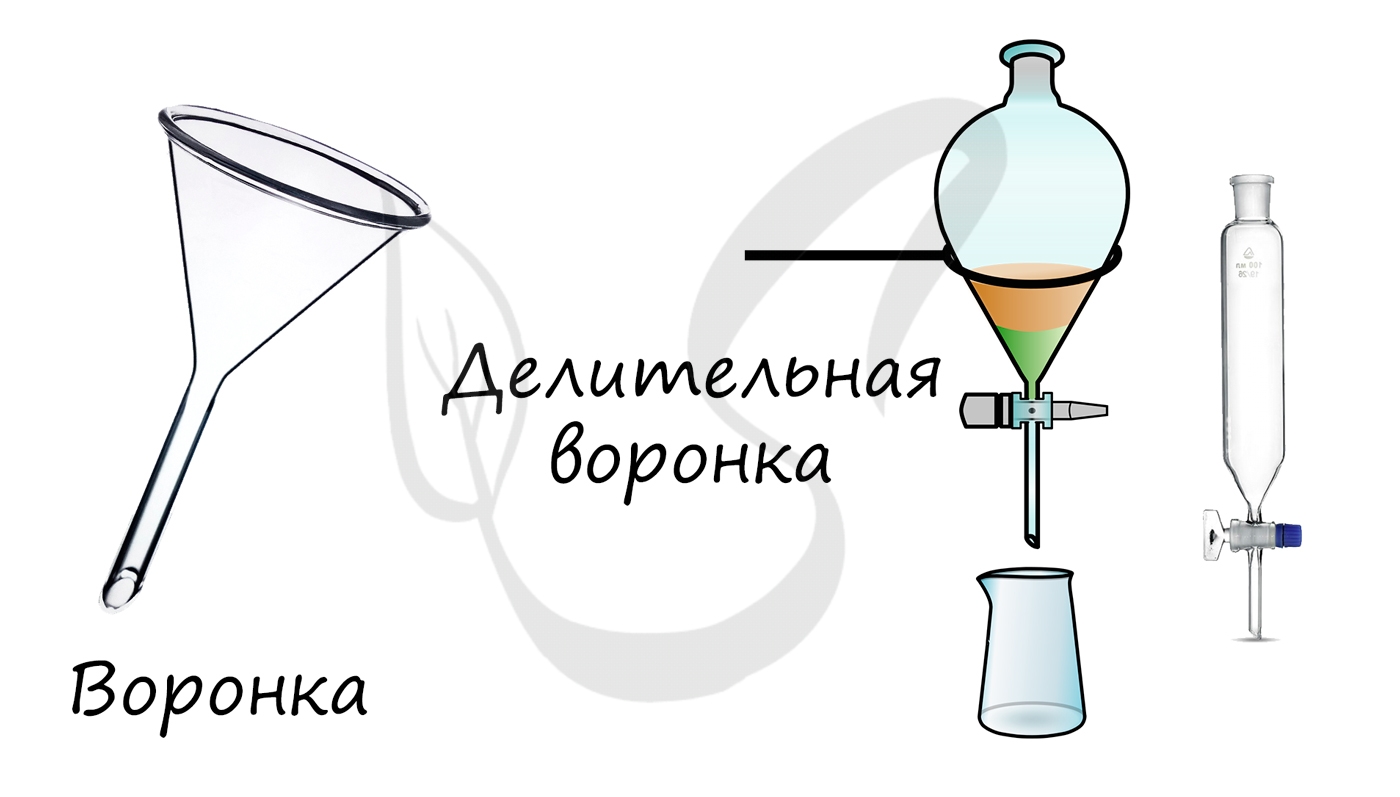
| конусная воронка |  | стекло | для переливания жидкостей |
| чашка |  | фарфор | для выпаривания растворов, измельчения твердых веществ |
3. Как вы думаете, почему для изготовления химической посуды наиболее часто используется стекло?
Так как стекло прочное, химически стойкое, инертное. С ним не взаимодействует большинство химических веществ.
4. Назовите лабораторное оборудование.
Для чего предназначена химическая посуда?
Правильно подобранная химическая посуда – основа естественнонаучной деятельности. В лаборатории можно увидеть десятки колб, емкостей, чаш, воронок, которые имеют свое назначение. Отвечая на вопрос: «Для чего предназначена химическая стеклянная посуда?», необходимо выделить ее типы. В целом, есть 3 разновидности:
Лабораторная посуда: виды, назначение, применение
На данный момент существует множество видов лабораторной посуды, необходимой для проведения экспериментов и анализов. Вся она изготовляется из стекла или других материалов высокой прочности, позволяющих выдерживать температуры. Также лабораторная посуда подлежит обязательной сертификации, изготавливается по нормам ГОСТа. Попробуем разобраться с основными видами.
Воронки
Служат для переливания жидкостей. Диаметр составляет 35 – 300 мм. Обычно воронки имеют гладкую внутреннюю стенку, но иногда встречаются и рифленые.
При работе воронку устанавливают на специальный штатив, а также изготовляют держатель.
Колбы
Существует несколько основных разновидностей колб:
Пробирки
Необходимы для сбора анализов, проведения экспертизы, отбора проб веществ. Изготовляются из прочного стекла, реже – из пластика. Бывают центрифужными, биологическими, с пробкой и без нее.
Самый известный подвид – чаша Петри, стандартный размер составляет 50—100 мм. Активно используется биологами для выведения культур микроорганизмов. Также позволяет сохранять частицы препаратов, травить печатные платы.
Все чаши поддаются стерилизации, кроме тех, которые изготовлены из пластика. Они поставляются в герметичной упаковке и являются одноразовыми.
Мерная посуда
К этому типу относятся мерные цилиндры, пипетки, мензурки, имеющие шкалу. Они, как правило, не переносят высокие температуры.
Стаканчики для взвешивания
Эту посуду выделяют в особую группу. Низкие и высокие стаканы необходимы для того, чтобы выделить точную долю вещества, а также соблюсти пропорции. Изготовляются из специального стекла по ГОСТу 21400-75.
Холодильники
Этот лабораторный инструмент используется при перегонке, для конденсации жидкости, а также отделении компонентов (фракционная перегонка). Существует более 9 разновидностей холодильников, самые популярные из которых – Либиха и Веста.
Лабораторный инструментарий
Инструменты часто относят к химической посуде, виды и классификацию которой мы рассмотрели.
В каждой лаборатории или экспериментальном бюро должны быть полные наборы, позволяющие ставить опыты.
Из какого стекла делают посуду для химических исследований?
Она изготавливается из особых сортов стекла. Например, Б-2 содержит 73 % диоксида кремния, окиси алюминия, железа и других веществ. Стекло № 846 содержит около 4% окислов бора и магния. № 23 – приблизительно 4% борного ангидрида.
Главное требование, предъявляемое к посуде – термическая устойчивость. Например, чешское стекло «Симакс» способно выдерживать температуру от 100 до 312 °С (в зависимости от толщины стенок).
Также исследователи имеют такие требования:
Не меньшей популярностью пользуется кварцевое стекло. Оно хорошо переносит перепады, легко очищается. Кварцевые емкости выдерживают высочайшие температуры (до 1200°С), которые часто достигаются за счет нагревания под вакуумом. Изготавливается посуда из песка, который плавится при температуре 1600 °С. Однако от такого материала следует отказаться, если проводится эксперимент с щелочами или фтористоводородной кислотой.
В целом, кварц не такой хрупкий, как обычное стекло, но стоит весьма дорого.
Также посуда из стекла удобна тем, кто ее легко очищать в ультразвуковой мойке. Это полезная опция, особенно если речь идет о частых экспериментах, во время которых использование пластиковой тары не представляется возможным или является достаточно затратным.
Купить химпосуду
Широкий выбор лабораторной посуды и принадлежностей Вы всегда найдете в нашем каталоге.
Лабораторная работа №1. Химическая посуда.
Цель работы – изучить имеющуюся в лаборатории химическую посуду, освоить технику работы с ней.
Требования к содержанию, оформлению и порядку выполнения: ознакомиться с техникой выполнения эксперимента, провести опыт, записать наблюдения, составить уравнения реакций
Общая постановка задачи: выполнить эксперимент и оформить отчет о проделанной работе
Химическая посуда делится на стеклянную и фарфоровую. Основными требованием, предъявляемым к стеклянной посуде, является ее химическая устойчивость. Химическая устойчивость – это свойство стекла противостоять разрушающему действию растворов щелочей, кислот и других веществ. Термическая устойчивость – способность посуды выдерживать резкие колебания температуры
Вся посуда по назначению делится на несколько групп:
— общего назначения (используется для выполнения нескольких химических операций): пробирки, стаканы, плоскодонные, конические и круглодонные колбы, колбы Вюрца (круглодонные с газоотводной трубкой), кристаллизаторы, воронки, часовые стекла, бюксы;
— мерная посуда: цилиндры, мензурки, пипетки Мора и градуированные пипетки, мерные колбы;
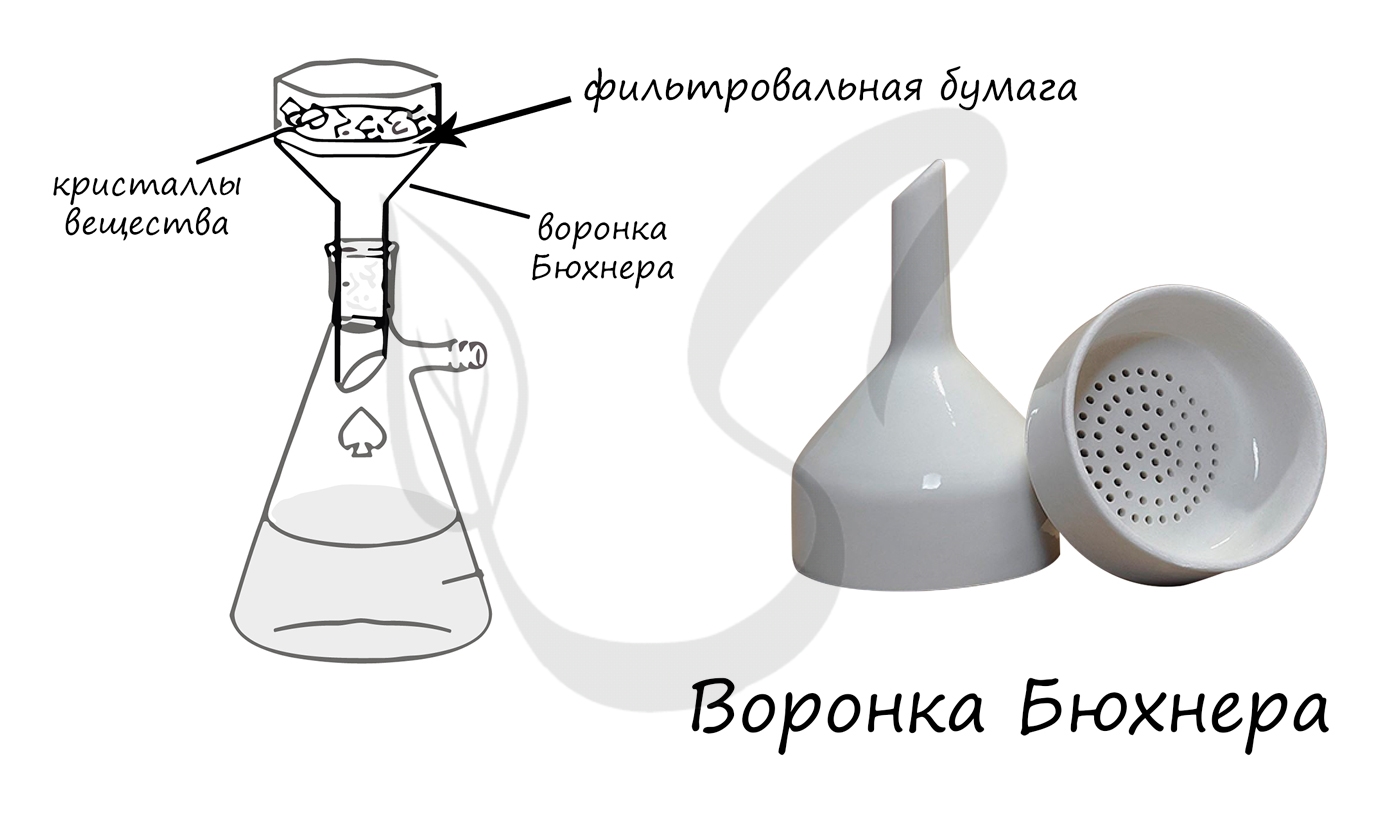
— посуда специального назначения: осушительные склянки (Тищенко, Вульфа, Дрекселя), аппарат Киппа, установка для фильтрования под вакуумом, которая состоит из колбы Бунзена, воронки Бюхнера, склянки-ловушки и водоструйного насоса;
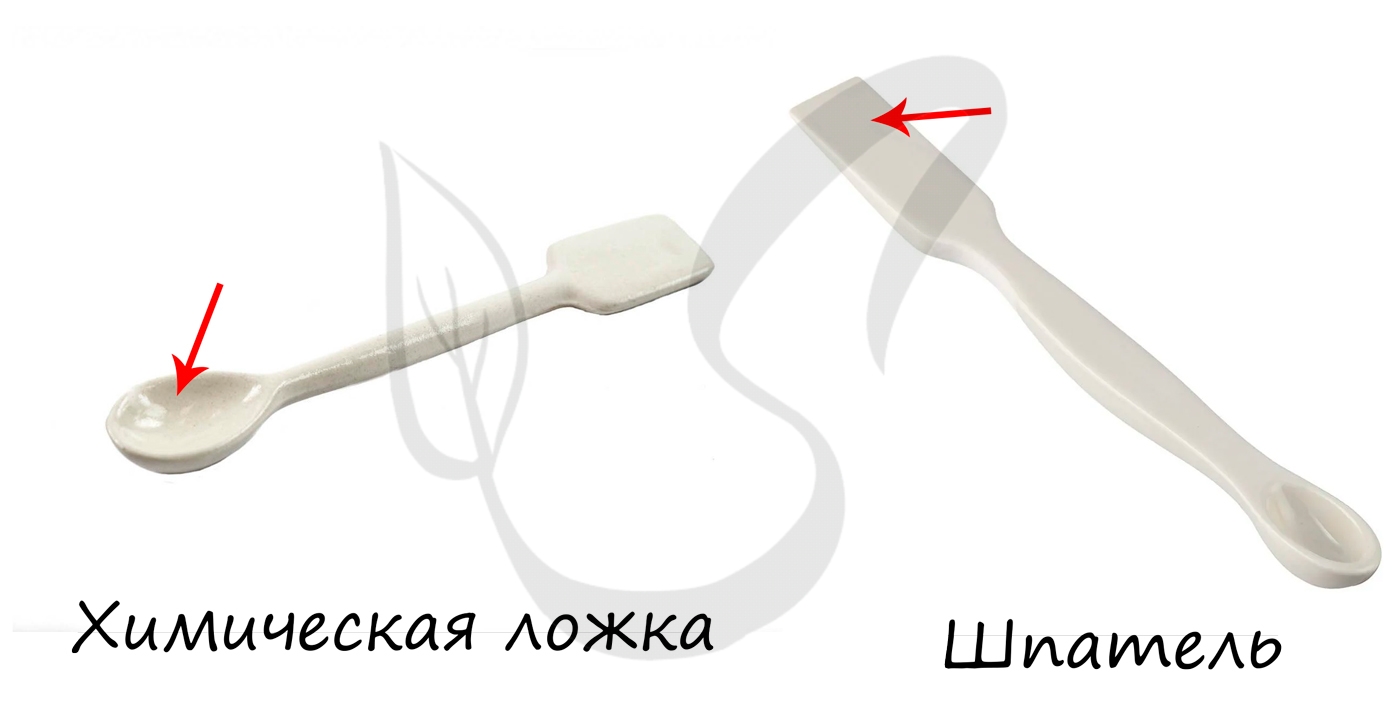
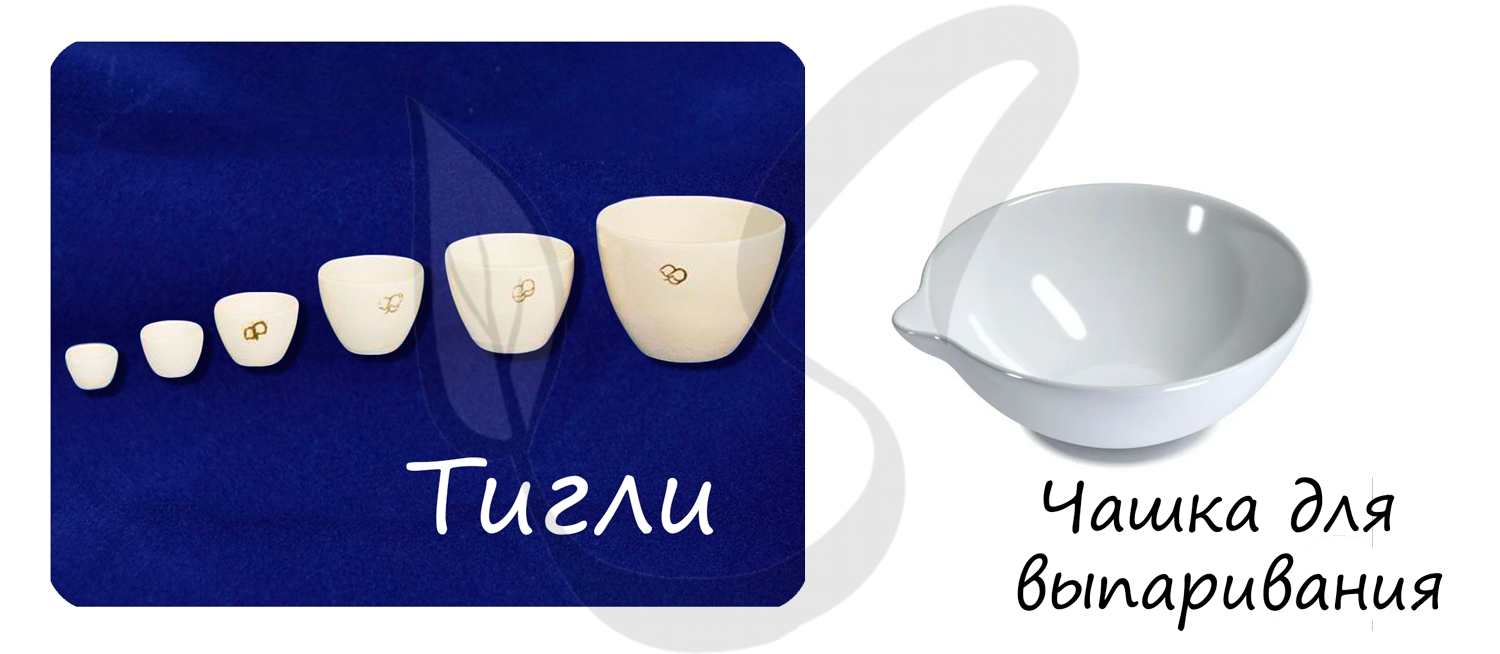
— посуда из фарфора и других материалов: шпатели, ступки, выпарительные чашки, тигли.
Список индивидуальных данных: получить у лаборанта химическую посуду для проведения экспериментальной работы.
Пример выполнения работы
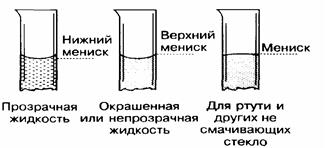
Фильтрование
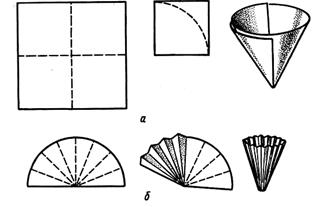
Простой фильтр готовят из квадратного куска фильтровальной бумаги, перегибая его дважды: сначала по одной, а затем по другой пунктирной линии. Образовавшийся малый квадрат обрезают ножницами по дуге с таким расчетом, чтобы готовый фильтр был на 3-4 мм меньше воронки. Приготовленный фильтр развертывают в конус и помещают его в воронку так, чтобы он плотно прилегал к стенкам воронки. Затем воронку помещают в кольцо штатива, подставляют под нее стакан, наливают в воронку немного дистиллированной воды и дают ей стечь
При фильтровании, не взмучивая осадка, сливают жидкость по стеклянной палочке на фильтр. В стакан с осадком вливают небольшое количество чистого растворителя, перемешивают с осадком и снова осторожно сливают жидкость по палочке на фильтр. Такая операция называется декантацией. После нескольких декантаций последнюю порцию растворителя перемешивают с осадком и сливают по палочке на фильтр. Когда вся жидкость стечет, промывают осадок на фильтре 2—3 раза чистым растворителем.
Если целью фильтрования является получение жидкости, освобожденной от механических примесей, то применяют складчатый фильтр. Для его изготовления простой фильтр раскрывают и складывают по радиусу то в одну, то в другую сторону так, чтобы получилась гармоника, которую расправляют и вставляют в воронку.
При фильтровании сливают взмученную жидкость вместе с осадком по стеклянной палочке на фильтр.
Мытье и сушка посуды
Посуда, употребляемая для опытов, должна быть чистой, ее моют водопроводной водой с помощью специальных щеток — ершиков, а затем несколько раз ополаскивают дистиллированной водой. Если посуда очень загрязнена, к воде прибавляют немного соляной кислоты или моют ее «хромовой смесью» (смесь дихромата калия с концентрированной серной кислотой). Если необходимо быстро высушить посуду, ее помещают в сушильный шкаф. Мерную посуду моют тотчас же после употребления.
Контрольные вопросы и упражнения
1. Перечислить основные правила техники безопасности работы в химической лаборатории.
2. Правила оформления лабораторного журнала.
3. Перечислить виды химической посуды.
4. Перечислить стеклянную мерную посуду.
5. Перечислить фарфоровую посуду и ее назначение.
6. Правила работы со спиртовкой.
7. Правила работы с пипеткой.
8. Правила работы с бюреткой.
9. Изготовление фильтра.
10. Мытье и сушка посуды.
Способ оценки результатов
Работа оценивается исходя из следующих критериев:
допуск (включает устный ответ студента по технике выполнения экспериментальной части);
выполнение (включает практическое выполнение экспериментальной работы и оформление результатов в лабораторном журнале);
защита (включает сдачу коллоквиума по теории и выполнение практических манипуляций с химической посудой по индивидуальному заданию преподавателя)
Лабораторная работа №2 Основные классы неорганических веществ
Целью работы является получение и исследование свойств наиболее распространенных соединений.
Требования к содержанию, оформлению и порядку выполнения:ознакомиться с техникой выполнения эксперимента, провести опыт, записать наблюдения, составить уравнения реакций
Общая постановка задачи:выполнить эксперимент и оформить отчет о проделанной работе
Теоретическая часть: проработать теорию конспекта лекций по теме 2 раздела « важнейшие классы и номенклатура неорганических веществ».
Список индивидуальных данных:получить у лаборанта реактивы и химическую посуду для проведения экспериментальной работы.
Пример выполнения работы
Опыт 1. Получение и свойства оксидов
Взять щипцами небольшой кусочек стружки магния и поджечь его пламенем спиртовки. Горящий магний держать над фарфоровой чаш-кой. В чашку с образовавшимся оксидом магния добавить несколько миллилитров воды, размешать стеклянной палочкой и определить среду раствора индикатором фенолфталеином или универсальной индикаторной бумагой.
2. Получение оксида хрома (III) разложением соли.
Темно-зеленый оксид хрома Cr2O3 получают разложением гидроксида хрома (III) или хромосодержащих солей. Он применяется в качестве пигмента, катализатора, полирующего материала, вводится в стёкла для их окраски.
В фарфоровую чашку поместить небольшой горкой кристаллический дихромат аммония и ввести в центр горки горящую спичку. Наблюдать разложение соли, которое вначале идет медленно, а затем ускоряется. Схема реакции:
Описать опыт и указать, какое природное явление он напоминает в уменьшенном масштабе. Переписать схему реакции, составить к ней электронные схемы окисления и восстановления, определить стехиометрические коэффициенты перед веществами и тип реакции.
3. Получение оксида меди.
а) Тонкую медную пластинку зажать щипцами и внести в пламя спиртовки. Нагреть до почернения. Составить уравнение реакции.
б) Получить в пробирке голубой осадок гидроксида меди(П) Сu(ОН)2 взаимодействием нескольких капель раствора CuSO4 с раствором щелочи. Осторожно нагреть полученный осадок. Как изменяется цвет осадка? Составить уравнения реакций.
4. Получение СО2 в аппарате Киппа. Оксид углерода (IV) – углекислый газ – содержится в небольшом количестве в атмосфере (0,03 %) и в растворенном виде в некоторых минеральных источниках. В технике его получают прокаливанием известняка по реакции:
а в лабораториях – разложением мрамора соляной кислотой в аппарате Киппа по уравнению:
Главным потребителем углекислого газа является пищевая промышленность: производство сахара, пива, газированной воды. Он применяется также в качестве хладоагента (сухой лед), для тушения пожаров и в качестве нагнетающего газа для перекачки легковоспламеняющихся жидкостей. В химической промышленности диоксид углерода используется при получении кальцинированной соды – карбоната натрия Na2CO3.
В течение примерно трех минут большую пробирку наполнять углекислым газом из аппарата Киппа, затем внести в неё 10–15 капель раствора NaOH, тотчас закрыть пробирку смоченным водой большим пальцем и встряхнуть, после чего пробирка свободно повисает на пальце. Углекислый газ взаимодействует со щелочью, в результате чего в пробирке образуется вакуум и внешнее давление прочно прижимает ее к пальцу. Эту реакцию применяют в промышленности для удаления СО2 из газовых смесей.
Углекислый газ тяжелее воздуха, поэтому его можно «переливать», как воду. В течение примерно трех минут заполнять углекислым газом химический стакан емкостью 100 мл. Затем «перелить» газ во второй стакан и опустить в него горящую лучинку. Пламя гаснет, так как углекислый газ не поддерживает горения.
Написать уравнение реакции получения углекислого газа и его взаимодействия с NaOH. Сделать вывод о химической природе этого оксида.
Опыт 2. Свойства щелочей.
Гидроксиды-основания подразделяются на растворимые и нерастворимые. Растворимые основания – это гидроксиды щелочных и щелочноземельных металлов. Они называются щелочами.
а) В трех пробирках испытать действие индикаторов — фенолфталеина, лакмуса, метилового оранжевого — на раствор щелочи. Записать наблюдения.
б) Налить в стакан немного раствора щелочи, прибавив к раствору 2—3 капли фенолфталеина. Добавлять по каплям раствор кислоты (помешивая стеклянной палочкой) до исчезновения окраски индикатора. Составить уравнение реакции нейтрализации.
Опыт 3. Получение и исследование свойств малорастворимых
Оснований
Большинство металлов, кроме щелочных и щелочно-земельных, образуют малорастворимые в воде основания. Они применяются как сорбенты, катализаторы, красители и как исходные вещества при получении солей, оксидов и других соединений.
а) Получить осадок гидроксида никеля(П) Ni(OH)2, прибавляя к 2—3 каплям раствора соли никеля(П) избыток раствора щелочи. Испытать действие кислоты на полученный осадок. Что наблюдается? Составить уравнение реакции.
б) Поместить в пробирку 6—8 капель раствора соли свинца(П) Pb(N03)2 или Рb(СН3СОО)2. Прибавлять по каплям раствор щелочи до образования осадка. (После прибавления каждой капли щелочи пробирку встряхивать.) Отметить цвет осадка и написать уравнение реакции. Нагреть его в пламени горелки. Как изменяется цвет осадка? Записать наблюдения и составить уравнение реакции.
Опыт 4.Получение кислот.
Положить в пробирку немного кристаллов ацетата натрия CH3COONa и прибавить несколько капель H2SO4. Определить по запаху, какое вещество образовалось. Написать уравнение реакции.
Опыт 5.Свойства кислот.
а) В трех пробирках испытать действие индикаторов — лакмуса, метилового оранжевого, фенолфталеина — на разбавленный раствор любой кислоты. Записать наблюдения.
б) В четырех пробирках испытать действие разбавленного раствора серной или соляной кислоты на магний, железо, цинк и медь. При необходимости нагреть содержимое пробирок. В каких случаях наблюдается химическая реакция? Написать уравнения реакций. Отметить положение указанных металлов в электрохимическом ряду напряжений.
в) Испытать действие соляной или разбавленной серной кислоты на осадки гидроксидов меди(П) Си(ОН)2 и марганца(П) Мn(ОН)2, предварительно получив их в двух пробирках по реакции обмена между растворами солей меди(П), марганца(П) и NaOH. Записать наблюдения и составить уравнения реакций.
г) Поместить в пробирку кусочек карбоната кальция СаСO3. Приливать по каплям соляной или разбавленной азотной кислоты. Что наблюдается? Написать уравнение реакции.
Лабораторная посуда
Требования, которым должна соответствовать химическая посуда:
В данной статье мы классифицируем всю химическую посуду на три группы по ее назначению: мерная, немерная и специального применения.
Мерная химическая посуда
Мерная посуда имеет точную градуировку, нагреванию ее не подвергают.
Пипетки служат для отбора жидкостей (до 100 мл) и газов (от 100 мл)
Применяются для измерения точных объемов, титрования (метод количественного/качественного анализа в аналитической химии)
С помощью мерных колб, мензурок и цилиндров отмеривают и хранят определенные объемы жидкостей.
Немерная химическая посуда (общего назначения)
К такой химической посуде относятся изделия, многие из которых употребляются с нагревом: пробирки, стаканы, колбы (плоскодонные, круглодонные, конические), реторты.
Служат для переливания и фильтрования жидкостей. Делительные воронки применяются для разделения несмешивающихся жидкостей.
Сифон химический применяется для безопасного перекачивания жидких сред из бутылей, бочек, канистр. Особенно важен сифон в работе с агрессивными опасными химическими веществами.
Химическая капельница применяется для дозирования растворов и индикаторов.
Используются с целью взятия твердых и сыпучих веществ. Могут служить для перемешивания жидкостей.
Применяется для одновременного размещения и закрепления множества пробирок.
Химическая посуда специального назначения
Данная посуда отличается тем, что предназначена для какой-либо одной цели.
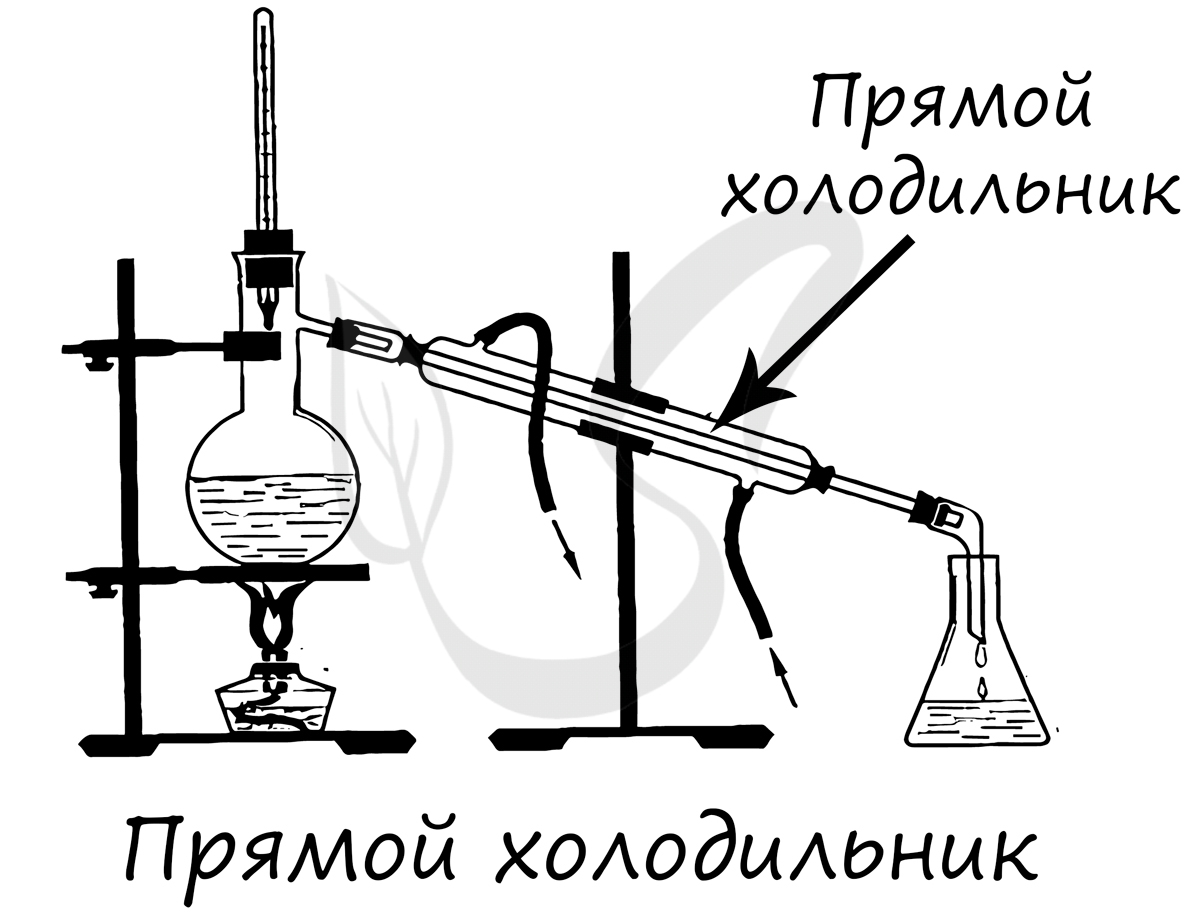
Круглодонная колба с отводом для вставки прямоточного холодильника. Используется для перегонки различных веществ.
Плоскодонная коническая колба, которая применяется для вакуумного фильтрования.
Применяется для фильтрования растворов при помощи фильтровальной бумаги под вакуумом.
Фильтр Шотта представляет собой стеклянную пористую пластинку. Фильтр Шотта используют в ходе вакуумного фильтрования.
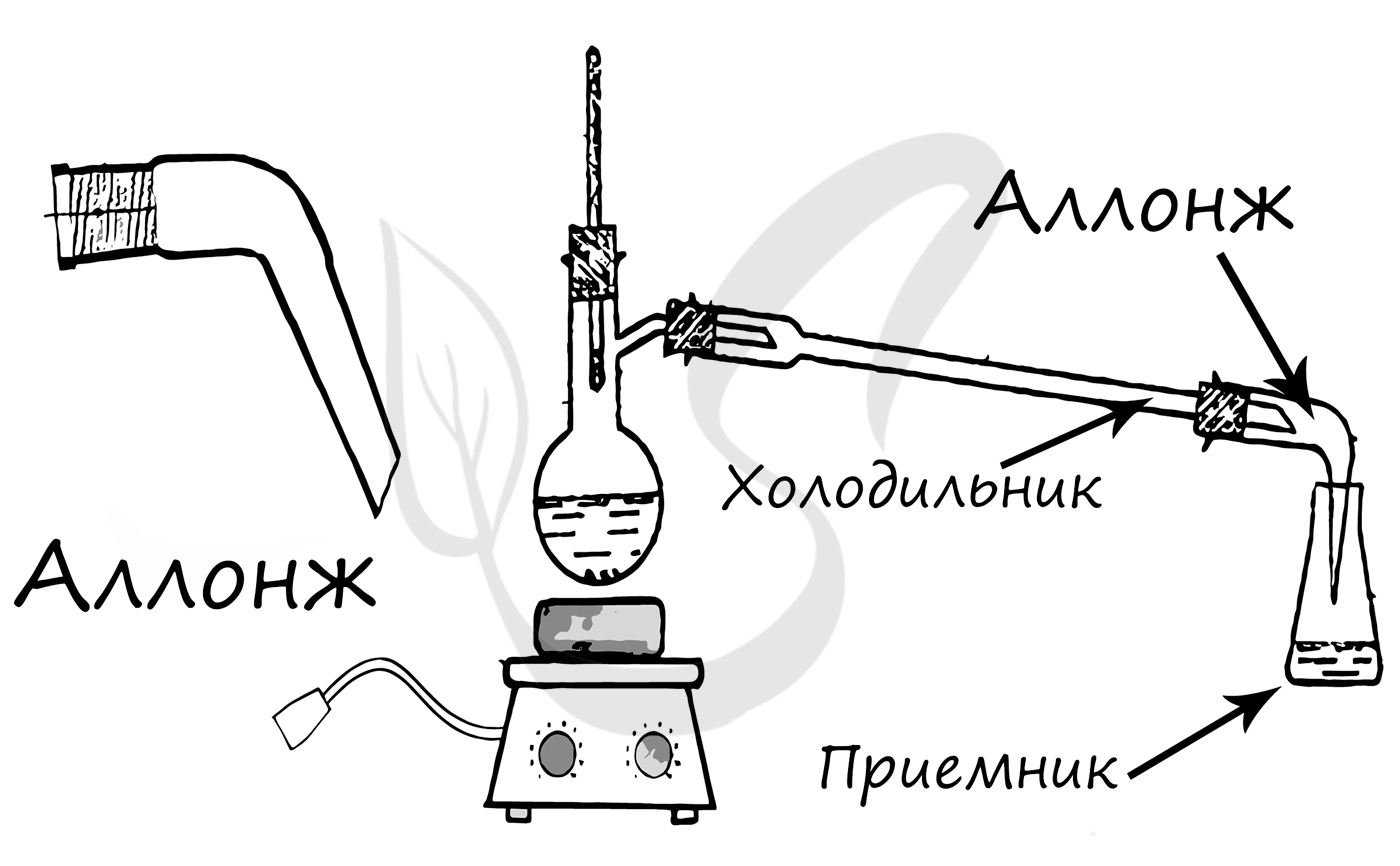
Применяется для конденсирования паров и отвода образовавшегося конденсата из системы, сбор конденсата происходит в колбу-приемник.
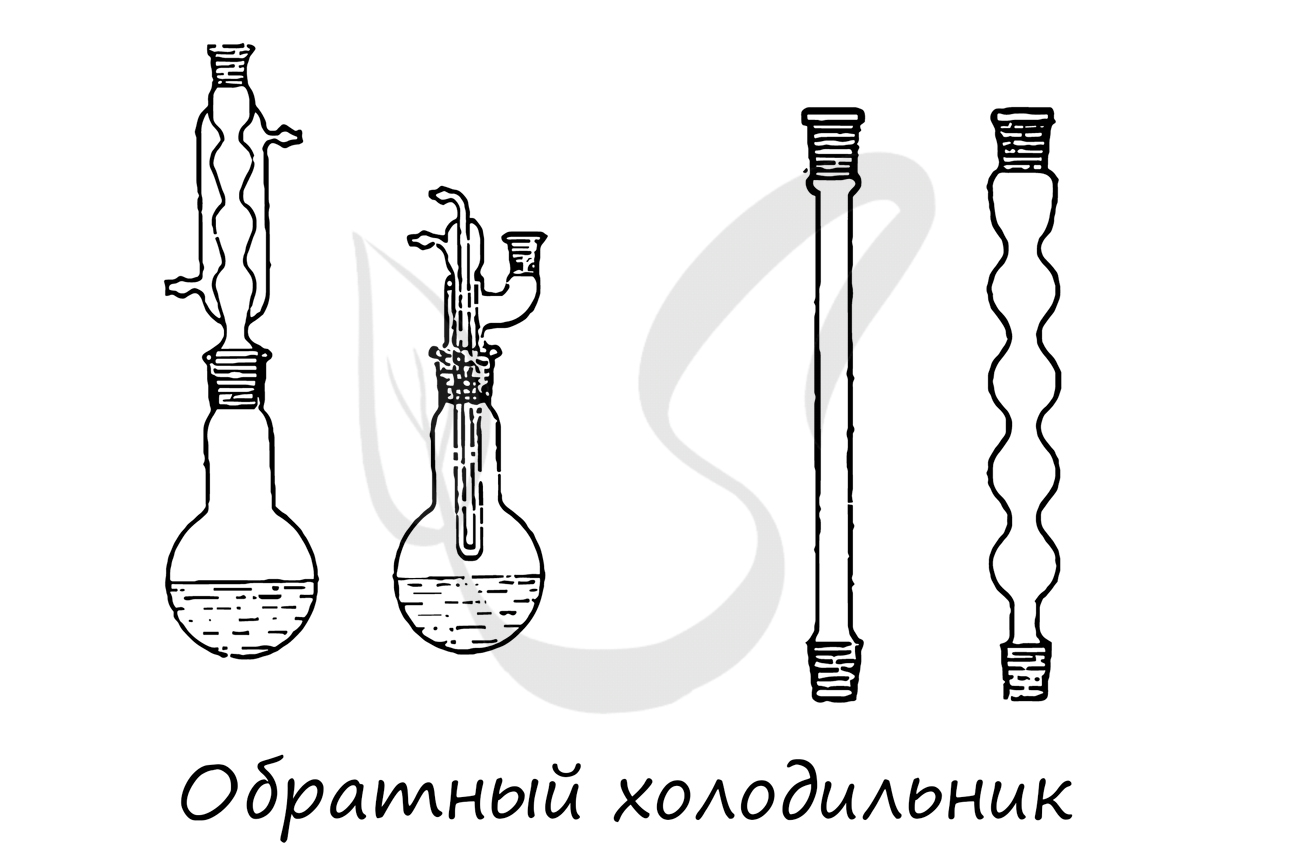
Применяется для конденсирования паров и возврата конденсата в реакционную массу. Обычно устанавливается вертикально.
Конструктивный элемент химических приборов, чаще всего используется для соединения холодильника с приемником.
Используется в качестве приемника при перегонке. Одним из предназначений колбы Кьельдаля является определения азота в веществах по методу Кьельдаля.
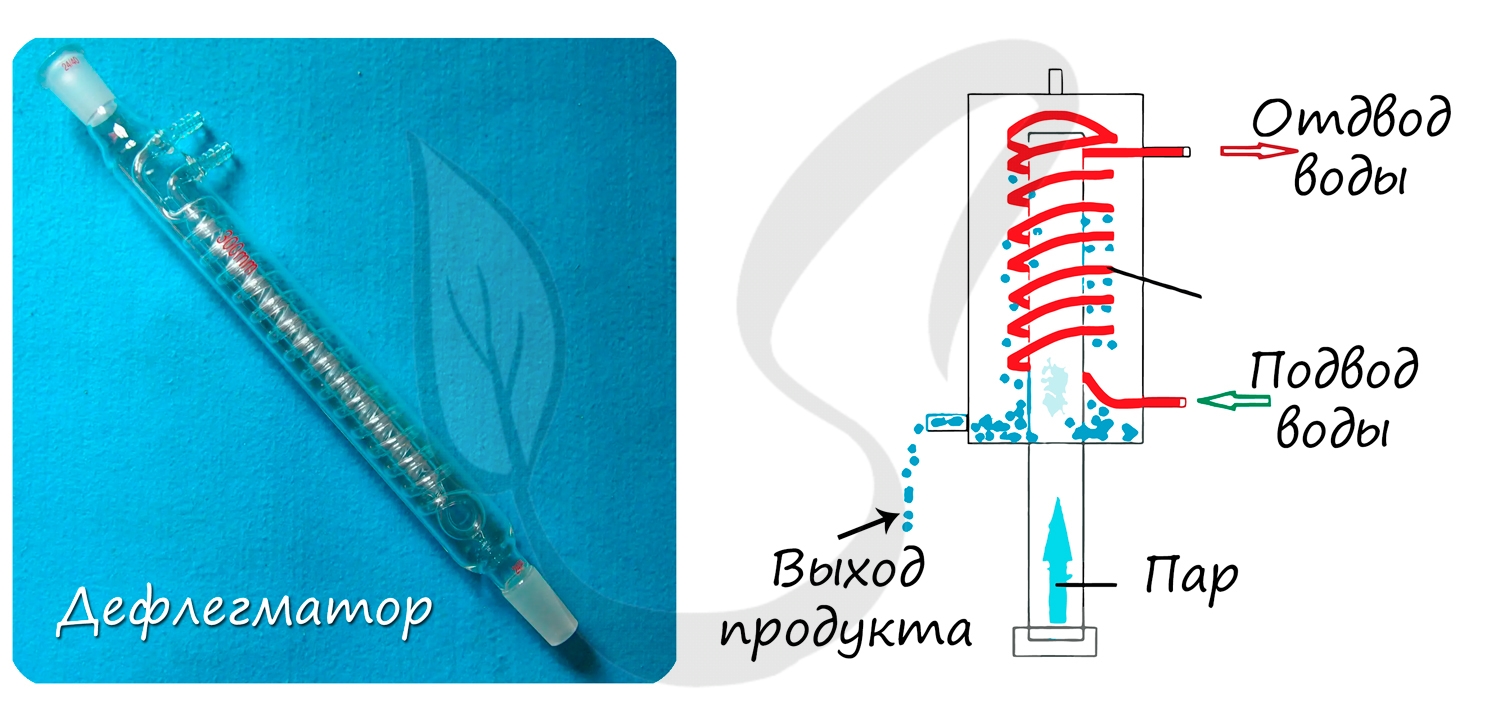
Используется для частичной или полной конденсации паров жидкостей, которые разделяют перегонкой или ректификацией (разделение, основанное на многократной дистилляции.)
Толстостенный стеклянный сосуд, с пришлифованной крышкой, на дно которого помещают влагопоглощающее вещество, в результате чего в эксикаторе поддерживается влажность воздуха приблизительно равная нулю. Эксикатор используется для высушивания и хранения различных веществ.
Служат для очистки газов от механических примесей. Также хлоркальцевые трубки применяют для предохранения растворов от попадания в них воды и углекислого газа: с этой целью их заполняют нужным поглотителем.
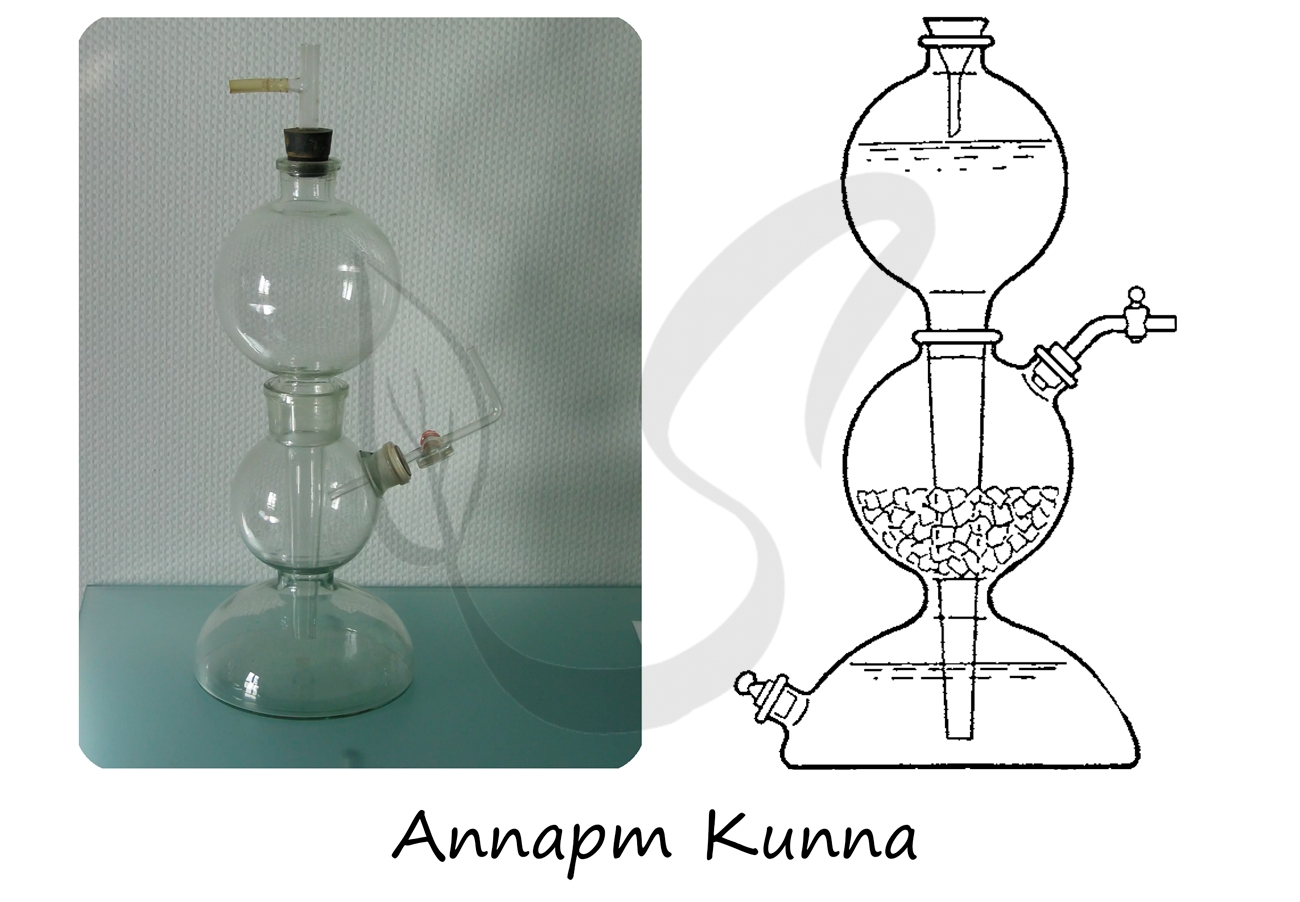
Применяется для получения газов при действии на твердые вещества растворов кислот и щелочей.
Чашки для выпаривания используют для выпаривания (упаривания) растворов.
Применяется для измельчения твердых веществ.
Применяются для прокаливания веществ в печи.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.